 Savon, liquide vaisselle ou lessive : il semble que tout ce qui lave a aussi la propriété de faire de la mousse. Et pourtant, ça n’est pas la mousse elle-même qui nous lave ! Son apparition n’est qu’un phénomène collatéral, lié à la nature physico-chimique des molécules qui sont le principe actif des produits nettoyants.
Savon, liquide vaisselle ou lessive : il semble que tout ce qui lave a aussi la propriété de faire de la mousse. Et pourtant, ça n’est pas la mousse elle-même qui nous lave ! Son apparition n’est qu’un phénomène collatéral, lié à la nature physico-chimique des molécules qui sont le principe actif des produits nettoyants.
Voyons pourquoi il est quasi-inéluctable que ce qui lave, mousse.
 Eau et huile comme chien et chat
Eau et huile comme chien et chat
C’est bien connu, l’eau et l’huile ne s’aiment pas. J’en veux pour preuve cette expérience enfantine où l’on cherche à mélanger de l’eau et de l’huile dans un verre, et ça ne marche pas : les deux liquides se séparent en deux phases.
La photo ci-contre montre l’expérience refaite dans ma cuisine. Ne vous fiez pas à l’inscription sur le verre, il s’agit bien d’eau et d’huile d’olive.
Bien sûr ceci est lié au fait que l’huile a une densité plus faible que l’eau. Mais pas seulement ! Pensez à l’alcool par exemple, qui lui aussi est plus léger que l’eau, mais ça n’est pas pour autant que dans ma bouteille de vodka de l’alcool pur surnage au dessus de l’eau.
La différence, c’est que l’eau et l’huile n’aiment vraiment pas se mélanger. On dit qu’ils sont non-miscibles, contrairement à l’alcool et l’eau qui s’accommodent bien l’un de l’autre. Donc l’eau et l’huile préfèrent rester chacun dans leur coin dès que c’est possible.
Cet affrontement entre l’eau et l’huile s’étend à beaucoup d’autres molécules : certaines aiment l’eau et pas l’huile (elles sont hydrophiles et lipophobes) tandis que d’autres aiment l’huile mais pas l’eau (elles sont hydrophobes et lipophiles).
Comment faire pour se laver ?
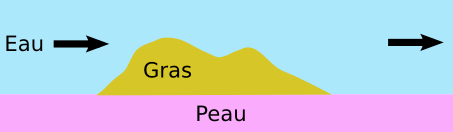
Le malheur dans tout ça, c’est que notre peau est plutôt dans le camp de l’huile. Elle est lipophile mais plutôt hydrophobe. En conséquence, notre peau préfère les saletés grasses que l’eau d’une bonne douche. D’ailleurs si vous regardez bien, l’eau ne mouille pas tellement notre peau : elle se met sur notre peau en gouttes, pour minimiser sa surface de contact.
Cela explique pourquoi il est difficile de se laver avec simplement un peu d’eau : la saleté (grasse) s’accroche sur notre peau (lipophile) et refuse de se laisser décrocher par l’eau !
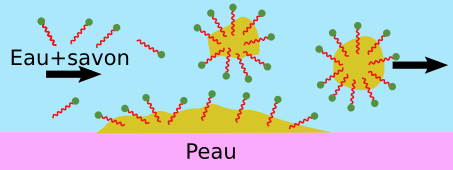
C’est là qu’intervient le savon car il contient des molécules qui permettent de réconcilier l’eau et le gras. On les appelle molécules amphiphiles, car elles aiment les deux à la fois : une partie de leur structure est hydrophile, tandis qu’une autre est lipophile (et donc hydrophobe).
Beaucoup de ces molécules ont une forme qui rappelle celle d’un spermatozoïde. On les représente d’ailleurs toujours comme ça. La formule ci-dessous montre un de ces composés amphiphiles, le SDS, qui possède comme structure une tête hydrophile (car polaire comme l’eau) et une queue composée d’une chaîne grasse, donc lipophile et hydrophobe.
Grâce à cette propriété, les molécules amphiphiles peuvent alors emprisonner les graisses à la surface de notre peau (ou de nos assiettes), et permettre qu’on les élimine par un flux d’eau.
Et voici comment tout cela fonctionne :
 Si vous voulez vous convaincre que le savon est bien capable de rendre compatibles l’eau et l’huile, refaites l’expérience du verre. Remplissez-le d’eau et d’huile, puis ajoutez du produit vaisselle et touillez un peu.
Si vous voulez vous convaincre que le savon est bien capable de rendre compatibles l’eau et l’huile, refaites l’expérience du verre. Remplissez-le d’eau et d’huile, puis ajoutez du produit vaisselle et touillez un peu.
Vous allez obtenir un mélange biphasique de petites gouttes d’huile dans l’eau, ce qu’on appelle une émulsion. Sans le liquide vaisselle, l’émulsion n’est pas stable, mais grâce à lui, l’huile peut accepter de se retrouver piégée dans l’eau. Les ennemis sont réconciliés.
Démonstration ci-contre, toujours dans ma cuisine !
Et d’où vient la mousse ?
Comme vous avez pu le constater, le mécanisme par lequel le savon nous lave ne fait en rien appel à l’existence de mousse. Ca n’est pas la mousse qui nous lave ! En fait la mousse est un effet collatéral des molécules amphiphiles.
Tout d’abord, vous savez peut être qu’il n’y a pas vraiment besoin de savon pour faire des bulles. Si vous faites sortir rapidement de l’eau du robinet, vous pouvez constater que quelques bulles se forment brièvement, mais ont une durée de vie bien faible. Pas de quoi en faire une mousse.
La raison de la faible durée de vie de ces bulles, c’est que tout comme l’huile, l’eau et l’air ne s’aiment pas vraiment. Ils ont donc envie de minimiser leur interface; or une bulle est une grande surface d’interface entre l’eau et l’air. C’est pour cette raison que les bulles créées sans savon ne sont pas stables.
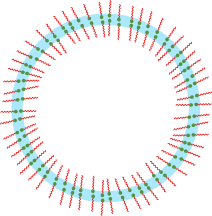 Mais de même que que les molécules amphiphiles permettent de rendre compatibles l’eau et l’huile, elles permettent de conserver les bulles en réconciliant l’eau et l’air. Les molécules amphiphiles se placent à l’interface eau-air (la tête dans l’eau et la queue en l’air) et assurent la stabilité du mince film d’eau qui constitue la bulle.
Mais de même que que les molécules amphiphiles permettent de rendre compatibles l’eau et l’huile, elles permettent de conserver les bulles en réconciliant l’eau et l’air. Les molécules amphiphiles se placent à l’interface eau-air (la tête dans l’eau et la queue en l’air) et assurent la stabilité du mince film d’eau qui constitue la bulle.
L’image ci-contre représente ce qu’est une bulle, c’est-à-dire une double couche de molécules amphiphiles qui stabilisent un mince film d’eau. Attention tout cela n’est pas à l’échelle car le film d’eau ne fait que quelques dizaines de nanomètres d’épaisseur !
Et voilà pourquoi les produits nettoyants sont aussi inéluctablement des produits moussants ! En réalité, suivant leur structure, les molécules amphiphiles peuvent être plus efficaces à l’interface eau/huile (on parle alors de détergents) ou à l’interface eau/air (on parle alors d’agents moussants).
Mais dans notre perception de consommateur, le fait de mousser est tellement associé au fait de nettoyer, que l’industrie cosmétique ajoute dans ses produits certains agents amphiphiles servant surtout à mousser, plus qu’à nettoyer !
Trois bonus pour les curieux :
1) mais qu’est-ce donc que le savon sans savon ? En fait le terme de savon désigne un type particulier de molécule amphiphile : les sels d’acides gras, qui sont les amphiphiles les plus couramment utilisés. Mais on peut avoir recours à d’autres types de molécules. Ma supposition pour les savons sans savon commerciaux : des tensio-actifs non-ioniques ??? Quelqu’un a une idée plus précise ?
2) Quand je suis parti pour deux semaines de voilier dans les îles (whaou!), j’ai pu vérifier que le savon classique ne marche pas dans l’eau de mer, alors que le savon sans savon fonctionne. Pourquoi ? Il semble que ce soit lié au fait que les molécules de savon peuvent précipiter en présence de certains ions, alors que certaines molécules amphiphiles alternatives seraient plus stables. Cette propriété semble aussi être liée au fait que ces molécules de savon sans savon respectent mieux le pH de la peau. Si ce sont bien des tensio-actifs non-ioniques, on comprend qu’ils ne varient pas au pH, alors que les savons sont amphotères, leur charge dépend du pH ambiant. Idem, si quelqu’un a une idée plus précise, je suis preneur !
3) Je découvre en écrivant ce billet que cette semaine la question de la détergence a aussi inspiré Sirtin, je vous recommande d’ailleurs ses autres billets sur le sujet cités à la fin de son dernier.





21 Comments
Canard en plastique, verre à chartreuse, … souvenir, souvenir, …
Mais Briceuuuuuuuu… non, rien.
La réponse à l’observation « le savon classique ne marche pas dans l’eau de mer » est le programme de terminale en chimie : les savons sont la plupart du temps des carboxylates d’acide gras, de la forme R-COO⁻.
Lorsqu’on ajoute des ions calcium Ca²⁺, il se forme un savon de calcium : 2 R-COO⁻ + Ca²⁺ → Ca(OOC-R)2
Concernant les ions sodium Na⁺, il s’agit d’un équilibre chimique : R-COONa ⇌ Na⁺ + R-COO⁻ L’ajout d’ions sodium va faire tendre la réaction vers la gauche (principe de La Chatelier) et provoquer la précipitation de carboxylate de sodium non polaire, donc qui ne lave rien du tout.
Autre chose : verser de l’acide chlorhydrique, et vous allez faire basculer vers la gauche la réaction R-COO⁻ + H⁺ ⇌ R-COOH, donc provoquer la précipitation d’acides gras insolubles, on fabrique de la graisse !
Merci pour le complément ! J’ai en effet un vague souvenir d’un TP de chimie en terminale sur la saponification…
Effectivement l’argument du déséquilibrage de la réaction avec le sodium est clair. Point besoin d’invoquer le pH !
Bon en tout cas je n’arrive toujours pas à trouver des exemples de surfactants de savon sans savon…je vais aller faire un tour à la pharmacie et lire les étiquettes !
Si on prend au pied de la lettre la définition d’un savon : composé résultant de l’action d’une base forte (NaOH ou KOH) sur des corps gras (réaction nommé saponification).
On peut déjà dire que le SDS NaSO4(CH2)11CH3 cité précédemment n’est pas un savon, c’est un détergent.
Je remets les choses en place : un détergent est un composé amphiphile capable d’enlever des salissures d’un support solide. Ce n’est pas un savon car il n’a pas un groupe carboxylate.
Il peuvent être de synthèse (comme le dodécylsulfate de sodium, le SDS) ou naturels (comme les phosphatidylcholines ou lécithines, ce qui explique qu’on arrive à faire une mayonnaise avec un jaune d’œuf sans mettre de savon).
Un tensioactif est une molécule capable de modifier la tension superficielle, les savons et les détergents y arrivent par leur propriété aphiphile. La plupart diminuent la tension superficielle, ce qui fait couler les trombones :
http://www.youtube.com/watch?v=uaEX7sgwjW8&feature=related
Et encore toutes mes excuses à Henry Le Chatelier pour avoir mal orthographié son nom !
Ah oui tient, ça me trottait dans la tête. En fait dans mon gel douche, il n’y a pas vraiment de surfactant qui soit un savon au sens « orthodoxe » du terme. Les principaux sont SLES, CAPB, etc. Donc finalement ça veut dire que la plupart des gels douche sont en réalité des « savons sans savon » ?
excusez-moi, je voulais dire :
verser de l’acide chlorhydrique, et vous allez faire basculer vers la droite la réaction R-COO⁻ + H⁺ ⇌ R-COOH, donc provoquer la précipitation d’acides gras insolubles, on fabrique de la graisse !
En effet, il semble que ça soit le cas !
Les lessives, les produits pour la douche, les nettoyants pour vitres, tous est détergents sans savon !
Tiens j’ai eu confirmation ce week-end. J’ai vu un gel douche fièrement étiqueté « sans savon », et qui pourtant contenait les tensio-actifs habituels : SLES, CAPB…mais scientifiquement parlant, ça n’est pas un mensonge ! (vis à vis du consommateur, ça se discute !)
J’ai une question, je me demande pourquoi un savon mousse t il plus ou moins en fonction de la dureté de l’eau ? Si quelqu’un sait, pourrait-il m’expliquer.
Merci d’avance
Bonjour,
La réponse à cette question est présente en partie dans mon précédent message : le savon est composé d’ions carboxylate qui réagissent avec les ions calcium Ca²⁺ et magnésium Mg²⁺, responsable de la dureté de l’eau. Ces ions précipitent le savon, qui ne peut donc plus faire autant de mousse.
Pour éviter ce problème, on ajoute parfois des chélateurs (genre EDTA) qui vont emprisonner ces ions et les empêcher de réagir. L’autre solution est d’employer des tensioactifs moins sensible à la dureté.
Pingback: La physico-chimie du pastis « Science étonnante
Pingback: La physico-chimie du pastis: pour tous les amateurs …un peu de culture pour arroser ce breuvage!! « Reso6259cotedopale
Pingback: L’eau en poudre | Science étonnante
Pingback: D’où viennent les bulles du champagne ? | Science étonnante
On a coutume de dire qu’on lave mieux à l’eau chaude qu’à l’eau froide. Comment intervient la température dans tout cela ?
Pingback: Bulles de savon géantes ! | Science étonnante
Pingback: CONCLUSION – Peut-on se laver avec du savon de Marseille dans de l'eau de mer ?
quels sont les spécificités d’un détergent qui mousse bien?
quels sont les spécificités d’un détergent qui ne mousse pas du tout?
merci de me répondre
salut
j’aimerai savoir quelle composante naturelle peut-on ajouter a un detergent bio pour qu’il mousse?
Me lavant les cheveux avec mes savons shampooing solide depuis plusieurs années, je constate que la mousse, assez abondante, « s’écroule » plus vite quand les cheveux sont très sales. Dans ces cas, je fais un second passage, moins chargé en savon et la mousse tient mieux. Je sais alors que les cheveux sont propres. Pourquoi la mousse s’écroule-t-elle plus vite quand les cheveux sont plus gras? Svp, pas de réponse avec des histoires de molécules mais quelque chose de plus accessible au public qui me questionne sur la mousse. Merci d’avance.