 L’eau est une substance merveilleuse qui possède de nombreuses propriétés physico-chimiques qui la distinguent de la plupart des autres molécules. Il se trouve que c’est grâce à l’une de ces propriétés que l’existence du ski est possible.
L’eau est une substance merveilleuse qui possède de nombreuses propriétés physico-chimiques qui la distinguent de la plupart des autres molécules. Il se trouve que c’est grâce à l’une de ces propriétés que l’existence du ski est possible.
Parmi les propriétés exotiques de l’eau, une des plus connues est sans doute le fait que l’eau augmente de volume quand elle se solidifie, ou une autre manière de le dire : la densité de la glace est inférieure à celle de l’eau liquide.
En effet un solide cristallin possède une structure ordonnée et périodique alors qu’un liquide possède une structure désordonnée. Et en général une structure ordonnée est plus dense qu’une structure désordonnée, car elle permet de faire tenir plus d’atomes dans un volume donné.
Si vous n’êtes pas convaincus, videz une boite de sucre sur la table et essayez de les ranger de manière désordonnée !
Mais pour l’eau, c’est différent ! Bizarrement la structure ordonnée occupe plus de place que la structure désordonnée, et donc la glace est moins dense que l’eau liquide.
Mais saviez-vous que c’est pour une raison étroitement reliée à ce phénomène que l’existence du ski est possible ?
Le diagramme de phase de l’eau
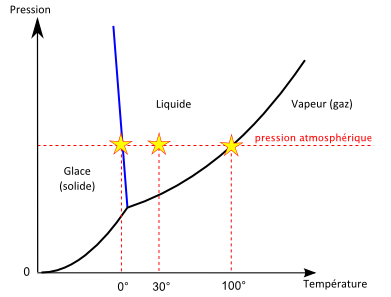 Un diagramme de phase est un graphique qui nous indique la phase (solide, liquide ou gazeuse) sous laquelle un corps existe dans les différentes gammes de température et de pression. Le diagramme de phase de l’eau est représenté ci-contre.
Un diagramme de phase est un graphique qui nous indique la phase (solide, liquide ou gazeuse) sous laquelle un corps existe dans les différentes gammes de température et de pression. Le diagramme de phase de l’eau est représenté ci-contre.
On retrouve par exemple sur ce diagramme qu’à pression atmosphérique, l’eau est liquide à 30°C, devient solide en dessous de 0° et vapeur au-delà de 100°C.
Mais on y voit aussi qu’à des pressions autres que la pression atmosphérique, les températures de solidification et de vaporisation sont différentes. Par exemple à pression très faible, on peut passer directement de la phase solide à la phase gazeuse, c’est la sublimation.
Une célèbre pente négative
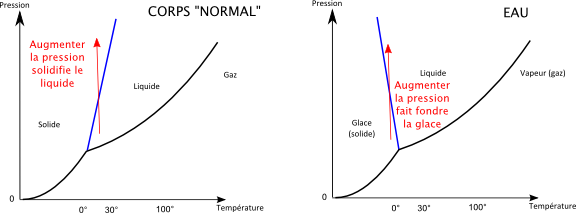
La caractéristique très inhabituelle du diagramme de phase de l’eau est que la courbe de fusion a une pente négative. Cette courbe représentée en bleu sur le diagramme représente la température à laquelle la glace fond sous différentes pressions. L’eau est de ce point de vue « anormale » car pour la quasi-totalité des corps, cette pente est positive.
Le fait que cette pente soit normalement positive est d’ailleurs étroitement lié au fait que pour la plupart des corps, le solide est plus dense que le liquide. En effet une pente positive signifie que si on se place à une température ou le corps est liquide, et qu’on augmente la pression, on devient solide. Et intuitivement c’est normal, puisque qu’augmenter la pression, c’est un peu comme réduire le volume, et que pour un corps normal, le solide occupe moins d’espace que le liquide.
Oui mais pour l’eau c’est l’inverse ! Le solide occupe plus de place que le liquide, et donc augmenter la pression sur la glace finit par la faire devenir liquide. Le diagramme ci-dessous montre la différence entre un corps normal et l’eau lorsqu’on augmente la pression à température donnée.
Que se passe-t-il quand on skie ?
Cette fameuse pente négative est la raison pour laquelle le ski est possible. En effet la glace qui forme la neige est un solide, et les skis sont également des matériaux solides. Or en principe deux solides ne glissent pas l’un sur l’autre.
Si le ski est possible, c’est parce qu’une fine pellicule d’eau se forme entre la neige et les skis, pour la raison que nous venons de voir : c’est la pression du ski qui liquéfie la neige. En fait on ne skie par vraiment sur la neige, mais plutôt sur l’eau. Donc le ski alpin n’est pas très loin du ski nautique !
Si à la place de l’eau on cherchait à skier sur un corps dont la pente est positive, le fait d’appliquer une pression ne produirait aucune liquéfaction, et glisser serait impossible ! C’est donc un petit miracle que le ski existe (comme le patinage d’ailleurs).
Skier sur du gallium ?
 En réalité l’eau n’est pas le seul corps possédant cette fameuse pente négative. Il nous faut rechercher parmi les corps qui augmentent de volume en se solidifiant. Mais les candidats ne sont pas nombreux. Parmi eux : le silicium, le gallium, le bismuth, l’antimoine, le germanium et le plutonium.
En réalité l’eau n’est pas le seul corps possédant cette fameuse pente négative. Il nous faut rechercher parmi les corps qui augmentent de volume en se solidifiant. Mais les candidats ne sont pas nombreux. Parmi eux : le silicium, le gallium, le bismuth, l’antimoine, le germanium et le plutonium.
Donc si on veut skier sur autre chose que de l’eau, il n’y a pas beaucoup de choix ! Le silicium fond normalement à 1410°, c’est un peu loin. Pour le plutonium, on va oublier. Mais personnellement j’ai un petit faible pour le gallium. En effet à pression atmosphérique, le gallium fond à 30°C, ce qui le rendrait idéal pour créer des pistes de ski praticables quand la température ambiante est comprise entre 0° et 30°.
Eh, je vais peut être lancer un nouveau concept, moi…
Réf: Sur les propriétés magiques de l’eau
Pour les courageux : vous pouvez vous amuser à analyser le diagramme de phase de l’eau et en particulier cette fameuse pente négative. Si on fait le calcul quantitativement en prenant la pression typique exercée par les skis (un skieur de 80 kg, deux skis de 2m de long et 10cm de large) sur la neige, on voit que si la température est trop négative, ça n’est pas suffisant pour provoquer la liquéfaction de l’eau. Il y a donc d’autres phénomènes en jeu, comme le fait que les molécules d’eau en surface de la glace sont moins liées que celles situées au coeur, et sont donc plus facile à libérer pour former une pellicule d’eau sur laquelle glisser.



10 Comments
Pingback: Tweets that mention Skier sur du gallium « Science étonnante -- Topsy.com
HJLa
La pente est elle suffisamment négative pour que la pression des skis suffisent a faire fondre les flocons? Jusqu’ici je pensais que c’était l’échauffement du au frottement qui me procurait ces merveilleuses sensations (d’ailleurs j’y retourne demain 🙂 )
A part ça ça coûte combien une tonne de gallium?
En effet comme je le mentionne tout à la fin, en regardant la pente et en calculant l’ordre de grandeur de la pression du ski, on voit que ça ne suffit pas, surtout s’il fait déjà quelques degrés en dessous de zéro. Donc il y a clairement d’autres phénomènes qui concourent pour former la pellicule d’eau. Par contre pour le patineur ça se discute car la pression est supérieure de plusieurs ordres de grandeur !
Quant au prix du gallium…euh…moins cher que le plutonium je pense !
Ah je n’avais pas remarqué le paragraphe en italique en première lecture. 2 remarques :
1 – la neige n’est pas aussi compacte que la glace, donc seule une fraction de la surface des skis appuie sur les flocons… pourtant je skie plus vite sur la glace que dans la poudreuse…
2 – depuis quelques années, la plupart des patineurs de vitesse utilisent des lames dont la partie métallique en contact avec la glace est minime et isolée thermiquement de la chaussure. L’idée est que la lame s’échauffe par friction lors du démarrage pour faciliter la glisse (le règlement interdit de les chauffer artificiellement)
Dans les 700$ le kg de gallium… pffff c’est encore une histoire de gros sous qui va limiter la recherche scientifique…
« la neige n’est pas aussi compacte que la glace, donc seule une fraction de la surface des skis appuie sur les flocons… pourtant je skie plus vite sur la glace que dans la poudreuse… »
Certes mais le film d’eau liquide s’établit bien plus facilement entre la glace et la semelle du ski, sur une surface supérieure…
Hélas c’est un voeu pieux: abaisser la température de fusion de l’eau ne serait-ce que d’un degré nécessite une pression d’environ 100 bar, soit 100 fois la pression atmosphérique, ce qui est matériellement impossible… Il s’agit en fait des frottements exercés par le patin sur la glace qui la font fondre : http://www.simplyscience.ch/techniques-et-materiaux-jeunes/articles/comment_les_patins_et_les_skis_glissent-ils_sur_la_glace_et_la_neige.html
A voir si ça marche avec du gallium !
Bon, la pression patin/glace est loin d’être négligeable : je pèse 100 kg et si j’estime à 1cm2 la surface de contact, ça fait bien 100 bars de pression … Mais ok, 1° n’est pas suffisant.
Pingback: Physique - persosn | Pearltrees
Des émules pour le poisson d’avril 2017 :
https://www.drgoulu.com/2017/04/01/des-pistes-en-gallium-aux-jo-dhiver-2018/#.WOJjnGekK70