 Nous vivons en ce moment une crise énergétique. Chaque jour on entend qu’il faut économiser l’énergie, que nos ressources d’énergie s’épuisent, ou qu’il faut trouver de nouveaux moyens d’en produire.
Nous vivons en ce moment une crise énergétique. Chaque jour on entend qu’il faut économiser l’énergie, que nos ressources d’énergie s’épuisent, ou qu’il faut trouver de nouveaux moyens d’en produire.
Et pourtant dans le même temps, en cours de physique, on apprend que l’énergie se conserve : elle ne peut être ni créée, ni détruite. N’y a-t-il pas là une contradiction ? Pourquoi nous parle-t-on d’économiser l’énergie, si l’énergie se conserve ?
Pour comprendre cet apparent paradoxe, il faut faire appel à cette étrange notion qu’est l’entropie. Et nous allons voir que ce que nous appelons communément la crise énergétique est en réalité une crise entropique !
Les différentes formes de l’énergie
En physique, l’énergie peut se présenter sous différentes formes. Il y a par exemple l’énergie cinétique, proportionnelle au carré de la vitesse, ou l’énergie potentielle de pesanteur, qui augmente avec l’altitude.
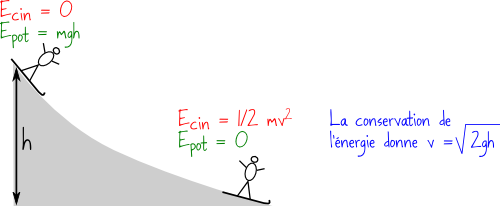
Souvent en cours de physique, on illustre tout cela en utilisant un skieur : en haut de la pente, ce dernier possède une énergie potentielle de pesanteur élevée, et en bas de la pente, le skieur a acquis de la vitesse et donc de l’énergie cinétique.
Si on dit que l’énergie totale du skieur est conservée, on peut calculer sa vitesse en bas, en écrivant que l’énergie cinétique finale est égale à l’énergie potentielle initiale, comme le montre le diagramme ci-dessous :
Tout cela fonctionne très bien, mais que se passe-t-il quand le skieur freine ? Il se retrouve en bas de la pente, son énergie potentielle est nulle, mais il est à l’arrêt donc son énergie cinétique est tout aussi nulle. Il a perdu toute son énergie ! Est-ce à dire que finalement l’énergie ne serait pas conservée, et qu’elle peut disparaître ?
Eh bien non, l’énergie est toujours là, mais elle est maintenant sous forme thermique. Quand le skieur freine, les frottements avec la neige produisent de la chaleur, et la température des skis et de la neige s’élève très légèrement. Cette production de chaleur au freinage n’est pas très visible avec un skieur qui s’arrête, mais beaucoup plus sur les plaquettes de freins d’une formule 1 !
Cette histoire de freinage et de frottements nous montre qu’au delà de l’énergie cinétique ou potentielle, il existe une autre forme d’énergie à considérer : l’énergie thermique. Pour pouvoir écrire que l’énergie totale d’un système isolé se conserve, il est indispensable de la prendre en compte. Très bien, mais nous allons maintenant voir que cette énergie thermique possède un statut bien à part.
Toutes les énergies ne se valent pas
Pour changer un peu du skieur, considérons un autre objet qui est un classique des cours de physique : le boulet de canon !
Prenons un boulet pesant 1kg, et imaginons que je désire augmenter son énergie totale de 10 000 Joules. Pour cela, je dispose d’au moins 3 moyens :
- L’emmener au sommet d’une montagne de 1000 mètres, je lui aurait ainsi donné environ 10 000 Joules sous forme d’énergie potentielle de pesanteur;
- Le propulser à 270 km/h, je lui donnerai alors 10 000 Joules sous forme d’énergie cinétique;
- Augmenter sa température d’environ 15°C, il recevra alors ses 10 000 Joules sous forme thermique.
Ces trois manières de donner de l’énergie à mon boulet peuvent paraître équivalentes, mais elles ne le sont pas ! Dans les deux premiers cas, je peux facilement récupérer l’énergie de mon boulet pour faire du travail. Imaginons que j’aie besoin de soulever un objet, je peux toujours (via par exemple un système de cordes et de poulies) récupérer l’énergie potentielle ou cinétique de mon boulet pour le faire. Avec l’énergie thermique, en revanche, pas moyen ! Mon boulet est chaud, mais impossible qu’il transforme tout seul cette chaleur en mouvement qui me permettre de récupérer mon énergie.
Cette petite comparaison entre ces 3 manières de donner de l’énergie à un boulet illustre un principe essentiel : toutes les énergies ne se valent pas, et l’énergie thermique est beaucoup moins « utile » que les autres.
De l’énergie de qualité ?
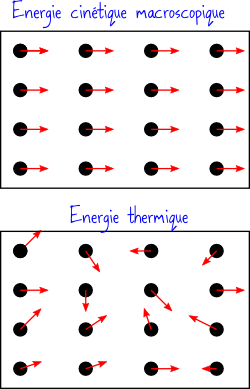 Pour comprendre pourquoi l’énergie thermique est moins intéressante que les autres, il faut se pencher sur les détails de sa nature. Au niveau microscopique, les atomes de la matière sont constamment en mouvement. Pour un gaz il se déplacent à peu près librement, pour un solide il sont contraints de rester à un certain endroit, mais ils peuvent osciller autour de leur position.
Pour comprendre pourquoi l’énergie thermique est moins intéressante que les autres, il faut se pencher sur les détails de sa nature. Au niveau microscopique, les atomes de la matière sont constamment en mouvement. Pour un gaz il se déplacent à peu près librement, pour un solide il sont contraints de rester à un certain endroit, mais ils peuvent osciller autour de leur position.
Plus la température d’un corps est élevée, plus les atomes qui le composent s’agitent à une vitesse élevée. L’énergie thermique, c’est donc tout simplement de l’énergie cinétique d’agitation des atomes qui composent votre objet.
Mais du coup, l’énergie thermique c’est comme de l’énergie cinétique, pourquoi serait-elle si différente ? La grande différence, c’est l’organisation ! Quand vous propulsez votre boulet de canon, vous lui donnez une vitesse macroscopique, et donc chaque atome qui le compose va se mettre en mouvement dans la même direction que ses voisins, et à la même vitesse. Alors que si vous chauffez votre boulet, chaque atome qui le compose va se mettre à osciller plus vite, mais tous les atomes vont le faire de manière désynchronisée. Dans un cas le mouvement est coordonné, dans l’autre il est désordonné. Dans un cas l’énergie est concentrée, dans l’autre elle est dispersée.
Cette idée nous explique en quoi l’énergie thermique n’est pas comme les autres : c’est une énergie dispersée au niveau microscopique, alors que l’énergie cinétique ou l’énergie potentielle sont concentrées au niveau macroscopique. Il y a donc bien une notion de « qualité » de l’énergie : et pour mesurer cette qualité, on va utiliser l’entropie.
Énergie libre & entropie
Reprenons notre boulet. Je vais lui donner à nouveau de l’énergie, mais en mélangeant deux moyens : je vais l’emmener en haut d’une montagne de 1000 mètres, et je vais aussi augmenter sa température de 15°C. Je lui donne donc au total 20 000 Joules : 10 000 J sous forme potentielle et 10 000 J sous forme thermique.
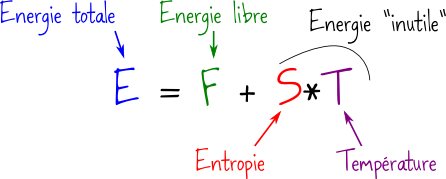
Nous l’avons dit, la partie « potentielle » est intéressante car nous pouvons la récupérer pour faire du travail : cette partie utile, nous allons l’appeler l’énergie libre. Quand on considère l’énergie totale d’un système, on peut toujours la découper en deux pour séparer l’énergie libre du reste, l’énergie « inutile ».
En pratique, on n’emploie pas cette notion d' »énergie inutile », et l’on utilise à la place la notion d’entropie. Pour des raisons sur lesquelles je n’ai pas besoin de m’étendre, ce qu’on appelle entropie (et qu’on note S) est en réalité l’énergie « inutile » divisée par la température T. Pour tout système, on a donc au final la décomposition de l’énergie total E en énergie libre F et partie inutile :
Ce qu’il faut retenir de cette décomposition, c’est que lorsque vous parlez d’un système (par exemple un boulet de canon), il ne suffit pas de donner son énergie totale, il faut aussi préciser son entropie, afin que l’on sache quelle partie de cette énergie totale sera inutile.
La crise entropique
Reprenons notre skieur en haut de la pente. Initialement son énergie est sous forme potentielle, donc concentrée et utile. Il se laisse descendre et acquiert de l’énergie cinétique, puis il freine et l’énergie se transforme en chaleur à cause des frottements.
Bilan de l’affaire : il a commencé plein de bonne énergie potentielle, et il termine sa course avec seulement de l’énergie thermique. Il a toujours autant d’énergie, mais la qualité de l’énergie n’est plus la même : l’entropie a augmenté !
L’air de rien, ce simple exemple nous fait toucher du doigt ce qu’on appelle les deux premiers principes de la thermodynamique, à savoir que pour un système isolé :
- Règle n°1 : l’énergie totale est conservée;
- Règle n°2 : l’entropie ne peut qu’augmenter (la qualité de l’énergie ne peut que se dégrader)
J’espère que vous voyez maintenant le lien avec la question de la crise énergétique : il se passe la même chose avec par exemple une voiture ou un avion. L’énergie d’un véhicule est initialement sous forme chimique (le carburant) ou électrique, c’est de l’énergie concentrée, mais au cours d’un trajet elle se changera irrémédiablement en énergie thermique : on ne perd pas d’énergie, mais l’entropie augmente.
Voilà notre paradoxe initial résolu : oui c’est vrai, l’énergie se conserve, mais au fur et à mesure qu’on la « consomme », la qualité de cette énergie diminue au fur et à mesure, et l’entropie augmente. La crise énergétique est donc bien au final une crise entropique !
Pour finir, je voudrais citer un professeur de mon père, qui résumait admirablement le fait que spontanément la qualité de l’énergie ne peut que se dégrader :
« Si vous descendez un escalier à califourchon sur la rampe, vous constaterez un léger échauffement de votre postérieur. En revanche, c’est pas en vous chauffant le cul que vous allez remonter ! »
Quelle meilleure illustration du second principe de la thermodynamique ?
Pour aller plus loin…
Parler de thermodynamique de manière simple est toujours un peu délicat. Dans ce billet, j’ai délibérément pris le parti de présenter l’entropie de la manière qui me paraissait la plus simple en utilisant les notions de mécanique que l’on aborde en lycée. Il faut savoir qu’il existe de multiples manières d’aborder ce concept, notamment par la mécanique statistique ou la théorie de l’information. Un point qu’il me semble important de préciser pour ceux qui voudraient creuser : les principes de la thermodynamique s’entendent pour un système isolé. En pratique, il est possible de récupérer l’énergie thermique contenue dans un boulet chauffé (par exemple en chauffant de l’eau et en faisant une machine à vapeur) mais cela implique des échanges avec l’extérieur (et l’entropie de l’univers augmentera quand même).
D’ailleurs pour les thermodynamiciens chevronnés, je propose une petite énigme qui m’est venue en écrivant ce billet, et pour laquelle je n’ai pas la réponse : imaginons que je prenne mon boulet chauffé, et que je l’enferme dans une boite qui l’isole de l’extérieur, avec dedans un panneau photovoltaïque. Le boulet va rayonner sa chaleur, une partie du rayonnement peut être absorbée par le panneau photovoltaïque et changé en électricité. Je passe d’une forme d’énergie thermique à une forme d’énergie potentielle. Cela viole le second principe de la thermo, donc il doit y avoir une erreur ! Quelque chose lié à l’équilibre du rayonnement entre le boulet, le panneau et la boîte ? Des suggestions ?
Billets reliés, ici ou ailleurs
- L’idée de ce billet m’est venue en écoutant The 2nd Law de Muse, qui aborde la question de la crise énergétique précisément sous l’angle de l’entropie ! Dr Goulu en parlait ici
- La gravité, une force d’origine entropique ?
- Xochipilli nous a souvent parlé d’entropie avec des perspectives différentes, comme ici et là
- D’autres billets sur l’énergie en mécanique : la physique du looping, les pièges du feu rouge ou une réflexion sur le record du monde de saut à la perche
Crédits
- Puit de pétrole, Wikimedia Commons
- http://www.fotopedia.com/items/6nf9pniglhbor-9VUDnDFXmTk
- Formule 1, Doug /Flickr CC
- Schémas : Science étonnante





71 Comments
Un bateau avalant l’eau de mer et recrachant des glaçons pour avancer, le rêve…
Pour le boulet dans la boite, je pense qu’il faut considérer l’entropie totale, chauffage du boulet inclus.
Je me suis toujours demande quelle était la part du réchauffement climatique due a l’effet de serre et celle due a l’augmentation d’entropie…
Les gaz a effet de serres (GES) empêchent une partie rayonnement infra-rouge (donc thermique) de repartir vers l’espace. Ils gardent de la chaleur (de l’énergie sous forme thermique) et font monter la température : donc augmenter l’entropie. L’augmentation de l’entropie est une conséquence de l’élévation des températures causés par le piégeabe d’énergie par les GES.
Cette idée de mettre le boulet dans une boîte avec un panneau photovoltaïque est impressionnante. N’ayant pas le niveau en physique pour garder l’esprit de pure scientifique, je ne prétend pas apporter une réponse. Y aurait-il des implications en physique quantique permettant d’inverser les effets de la 2nd loi de thermodynamique? Les frottements ne sont pas vraiment de la physique en tout cas. Mais la physique et les science en générale appréhende le monde d’après des observations et trouve des réponses au moyen d’expériences qu’elle interprète (la philosophie a plus comme volonté de se poser des questions sans toujours prétendre y répondre). Cela coupe tout raisonnement d’une vision plus subjective et donc parfois d’une manière un peu étriquée, même pour un scientifique chevronné. La question n’est pas « est-ce que telle ou telle chose est possible? » mais plutôt « comment définissons-nous telle ou telle chose? » Lorsqu’on dit que les énergies se perdent par l’entropie, il est en effet question d’un système isolé, cela s’entend pour la thermodynamique mais en réalité pour toute science d’une manière plus générale, par définition. D’où ce côté potentiellement étriqué puisque celle-ci aura pour « objet » un « système », selon une « expérience » qui se fera donc de manière « isolée » et selon une nécessité, car pris dans un contexte où la contingence et les vicissitudes de la vie n’auront pas prise (cf. « le hasard et la nécessité », Jacques Monod). Oui, au-delà des apparences, il existe aussi une chaleur « psychologique » qui, de son côté, peut elle aussi être source de bien des échanges. Pas de ceux qui feront tourner des moteurs ou remonter une pentes de ski sans élan, mais qui leurs seront pourtant intimement liés et d’une manière tout à fait indissociable. Quand on dit par exemple que « la nature a horreur du vide » ou que « nul n’est censé ignorer la loi » on parle dans les deux cas de science au sens restreint du terme, mais également de ces notions au sein desquelles nous intervenons aussi bien en « expérimentateurs » qu’en « cobayes », c’est à dire ni l’un ni l’autre mais bien indépendamment de tout pré-conditionnement. La crise est peut-être entropique mais je dirais aussi « néguentropique » selon le point de vue d’où on la regarde mais à condition de ne pas rester trop limité par les apparences – difficulté pour le physicien ou le scientifique, voire même plus largement pour l’homme moderne empêtré par son objectivité matérialiste insistante.
Merci pour votre blog et vos explication sur Youtube!
Bonjour,
Wiki (ça vaut ce que ça vaut) dit:
« Toute transformation d’un système thermodynamique s’effectue avec augmentation de l’entropie globale incluant l’entropie du système et du milieu extérieur. On dit alors qu’il y a création d’entropie. »
Je dirais qu’aucune isolation n’est parfaite et que la perte de chaleur à travers l’isolation est l’entropie.
« Je passe d’une forme d’énergie thermique à une forme d’énergie potentielle. Cela viole le second principe de la thermo »
Je pense qu’on passe de la lumière à une forme d’énergie potentielle; le chauffage du panneau par le boulet ne provoque pas la création d’énergie, c’est le rayonnement infra rouge du boulet qui arrive sur le panneau qui est transformé en énergie, non? Je ne suis pas thermodynamicien chevronné, je poste juste parce que je suis passionné 😉 désolé si je dis des bétises
L’energie des photons infra rouge n’est pas suffisante pour créer de l’électricité (il faut des niveaux changer niveaux orbitaux des électrons :ça se fait avec la lumière visible -solaire-). Ce qui se passe c’est que la chaleur diffusée par le boulet va chauffer le panneau (augmenter l’agitation des atomes(…). Va y avoir un transfert de chaleur avec création d’entropie et c’est tout…
En imaginant que le boulet rayonne dans le visible, il y aura production d’électricité et réchauffement du panneau jusqu’à équilibre thermique dans le système (isolé) panneau/boulet. Comme le système est isolé, l’électricité ne ressort pas donc elle doit bien faire quelque chose (et sans doute re-devenir de la chaleur via effet-Joule, le fameux U=RI).
Via ces transferts d’énergie il y aura création d’entropie.
Je pense qu’effectivement il faut chercher du côté de la température du panneau. S’il est initialement à la même température que le boulet, alors il est en équilibre radiatif avec lui, mais s’il est initialement à température inférieur, alors il va chauffer.
Ce qui me perturbe c’est qu’il me semble qu’on peut (au moins en théorie) minimiser la création de chaleur en imaginant un empilement de matériaux ayant des « gaps » différents et donc absorbant les différentes longueurs d’onde.
D’ailleurs on peut même formuler une version encore plus minimale du paradoxe :
Je prends un panneau photovoltaïque à une certaine température, je l’enferme dans une boite isolante d’emissitivité nulle (et de réflectivité totale), peut-il absorber sa propre énergie de rayonnement pour la convertir en électricité. La réponse doit évidemment être non, mais j’ai du mal à comprendre pourquoi.
Peut être qu’il faut considérer le système attaché au panneau :
Le panneau ne peut rendre de l’énergie utile que s’il est couplé à un circuit électrique : c’est lui qui va permettre le mouvement macro des électrons. Mais alors il faut aussi considérer ce qu’il y a dans ce circuit.
Par exemple une résistance qui va de nouveau dissiper l’énergie utile que le panneau a créé. Comme il fait partie du système isolé, et bien tu ne violes rien du tout.
Est-ce que l’intrication quantique entre deux photons peut justement permettre de récupérer l’énergie transformée par le panneau photovoltaïque et ainsi garantir l’isolement de la boîte?
Sinon merci pour tes blogs et vidéos. Toujours géniaux
Je suis revenu sur ce billet de blog quelques années après l’avoir lu et je pense avoir la solution du paradoxe!
Tout d’avoir je vais simplifier le problème, on va considérer que :
– Le système boulet + panneau est isolé (et on a donc du vide entre les 2)
– Le panneau est à une température de 0 K.
– Le panneau a un rendement de 100%
Le boulet va alors convertir son énergie thermique, en énergie électromagnétique, et à son tour en énergie électrique par le panneau. Ici la subtilité est de comprendre que Q=0, ce qui évidemment implique ΔS=0. En effet il ne faut pas confondre Q, qui est un transfert d’énergie thermique, avec la conversion d’énergie thermique en énergie électromagnétique. Dans notre cas il n’y a que de la conversion d’E thermique en E électromagnétique.
On peut comparer cette situation à un moteur de Carnot ayant une source froide de 0 K. Ce moteur a par définition un rendement de 100%, toute l’énergie thermique de la source chaude est convertie en énergie mécanique, pour autant il ne viole pas le 2nd principe de la thermo, car encore une fois dans ce cas il n’y a aucun transfert théorique mis en jeu : Q=0 ⇒ ΔS=0
Pingback: Crise énergétique ? Mais non, cri...
Mr David, vous dites: Le boulet va rayonner sa chaleur, une partie du rayonnement peut être absorbée par le panneau photovoltaïque et changé en électricité.
Or, il semble. en photovoltaïque, que les électrons ne sont émis que si la fréquence de la lumière est suffisamment élevée et dépasse une fréquence limite appelée fréquence seuil. Donc, pas de changement possible en électricité parce que lumière trop faible, non?
C’est juste mais je ne crois pas que ça résolve le paradoxe.
La fréquence seuil est liée au « gap » du matériau semi-conducteur. Pour le silicium cristallin utilisé habituellement c’est dans les 1000 et quelques nanomètres (proche IR, donc), mais si le gap du matériau et la température du boulet sont bien accordée, cela fera pas mal de radiation qui pourra être absorbée.
Et comme je le disais plus haut, on peut (toujours en théorie) imaginer des cellules de type « tandem » qui utilisent des semi-conducteurs avec différents gaps afin de ramasser une majorité du spectre.
Contrairement à ce que l’on pense, un panneau photovoltaïque est une machine thermique. Si vous recherchez des informations sur son rendement vous verrez qu’il est intimement lié à une différence de température, la source chaude qui l’éclaire et une source froide qui va maintenir le panneau à une température raisonnable. Donc en gros tant que le panneau et le boulet auront une température différente un courant électrique pourra être récupéré, mais à l’équilibre thermique, l’énergie envoyé par le boulet pourra effectivement envoyer les électrons de l’autre coté de la barrière de potentielle, mais le panneau étant à la même température, les électrons auront aussi l’énergie pour la passer dans l’autre sens.
Ah oui intéressant !
Effectivement une température non-nulle donne de l’énergie thermique qui provoque la recombinaison des porteurs (électrons et trous) après création dans le semi-conducteur mais avant leur séparation pour engendrer un courant.
Ce que je n’arrive quand même pas à comprendre, c’est pourquoi la température du panneau devrait augmenter. Si je me place dans le cas (idéalisé) où j’empile des matériaux de gap décroissant, chaque matériau absorbera des photons ayant une longueur d’onde à peine supérieure à son gap, donc la création de chaleur sera minimale.
Oui mais ce schéma là a ses limites, car si on se place dans un cas où les électrons ne circulent pas, alors on va séparer des charges mais les forces Coulombiennes vont très vite nous empêcher de continuer et le système sera bloqué. Si on décide de faire circuler les électrons pour par exemple recharger une batterie, alors le panneau et la batterie vont chauffer par effet Joules.
En parlant de sources chaudes et froides, pour créer un boulet chaud il a fallut le mettre en contact avec une source de température. Dès lors on peut considérer le boulet comme une source froide, la source qui l’a initialement chauffé comme une source chaude, et, puisque la deuxième loi de la thermodynamique autorise la conversion de chaleur en travail à la condition d’avoir (au moins) une source chaude et une source froide, le paradoxe est levé ! Mais peut être ai-je raté quelque chose…
Bonjour,
Le paradoxe se résout si on regarde votre formule d’énergie E = F + ST
Au début on a: E1=S1.T1
A la fin on a: E2=F+S2.T2
Et la conservation donne: S1.T1=F+S2.T2
Certes on a gagné du F, mais on a aussi perdu de la température T2<<T1.
Donc on peut bien avoir S2.T2S1
Ouf, rassuré en lisant le « Pour aller plus loin… ». En théorie et aux énormes pertes dues au rendement près, on pourrait envisager un système qui retransforme la chaleur des skis en Electricité (avec un thermocouple par exemple) qui actionne un petit moteur pour soit faire remonter la pente, soit redonner de la vitesse. Ce que mentionne trop peu l’article à mon avis c’est la partie de l’énergie qui a fait fondre la neige et c’est celle-là qui est difficile à récupérer. Ce que je veux dire c’est que ce qui cause la « crise entropique » c’est surtout le système qu’il faut voir dans son ensemble. Localement on peut diminuer l’entropie.
Pour l’énigme du boulet et du panneau photovoltaïque. Dès que l’on branche le panneau sur l’extérieur, le système n’est plus isolé. Les électrons mis en mouvement transfèrent l’énergie thermique vers l’extérieur de la boite.
Dans le cas du skieur, une grande partie de l’énergie est en fait perdue par un déplacement de la neige. Donc transfert d’énergie cinétique par contact. In fine, vu que la neige fini aussi par s’arrêter (le but n’étant pas de faire des avalanches), tout cela se termine par une augmentation de l’énergie thermique. Mais elle est répartie sur une (relativement) grande quantité de neige, en plus des skis (et des genoux) du skieur. Donc l’échauffement est faible.
Mais effectivement, la récupérer est impossible donc elle est grosso modo perdue.
Tiens ça me fait penser qu’on doit pouvoir reformuler le paradoxe du boulet avec l’effet Seebeck ! Ca doit même être certainement plus simple d’expliciter la faille.
Avec l’effet Seebeck c’est plus simple, c’est vrai. L’intérieur de la boite parfaitement isolée est la même que celle du boulet, partout, et donc la face arrière de la thermopile sera à la même température que la face avant. Il n’y aura donc aucun courant produit, exit le paradoxe !
Pour que la thermopile puisse faire du courant, il faut que la chaleur la traverse, autrement dit qu’il y ait un courant calorifique qui circule de l’entrée vers la sortie. Lequel ne peut être du qu’à la différence de température entre la source chaude et la source froide.
La situation est très différente avec la pile photovoltaïque, du moins en apparence : la chaleur (sous forme de photons) entre par l’avant, et…… mystère. L’énergie de ces photons est partiellement transformée en énergie électrique, et le reste… heu… dans le cas précis… (attendu que la pile est aussi à la température du boulet et du reste, elle ne peut pas chauffer).
Je présume que le problème est que la pile photovoltaïque ne peut pas fonctionner parceque, étant à la même température que le boulet, elle émet aussi un rayonnement vers le boulet (ou ailleurs dans la boite, ce qui revient au même). Une pile photovoltaïque utilisée en tant que capteur solaire reçoit un rayonnement émis à 6000 K ou quequechose du genre, mais elle ne se trouve qu’à 350 K environ et donc rayonne nettement moins que ce qu’elle reçoit. Suppositions…
Il serait intéressant d’aborder le pic pétrolier et l’équation de kaya.
http://manicore.com
Tout cela me fait penser au livre de François Roddier : Thermodynamique de l’évolution. Qui souffre, il faut le reconnaitre, de quelques incohérences mais dans sa structure global il permet de découvrir le versus énergie thermique et non thermique ! Et bien d’autre choses : un aperçu ici : https://www.youtube.com/watch?v=6lNz5vmKEFA
Un peu long la vidéo mais le livre se lit très bien !
Je profite de ce très bon article pour poser une question débile sur la conservation d’énérgie qui me perturbe…
E=mc2, ok donc 1 kg = 8,988×10^16 J
Je me lève un jour et décide de faire un petit régime. Ce jour là, je ne mange rien! (motivation oblige). Je vais bruler plus ou moins 2500Kcal=10,5×10^6 J. Le lendemain matin, c’est le top! j’ai perdu 1 kg…
Quelqu’un peut-il me dire ou est passée l’excédent énergétique (8,988×10^16 J – 10,5×10^6 J) ?
Dans le CO2 et l’eau rejetés 🙂
Oublie pas de prendre en compte l’O2 inspiré. Et en plus, l’équation E=mc2 s’applique plus logiquement aux systèmes ayant une petite masse qu’aux humains : la proportion d’énergie dans les liaisons chimiques dans la masse d’une molécule est environ 0,00000001% contre 99% pour un nucléon (nucléaire, cette fois).
Sinon, la gravité a varié entre les deux jours ? 😉
Attendez que je me souvienne des mes passés anciens. L’entropie, ce n’était pas une histoire d’eau chaude et d’eau froide qui pouvaient faire de l’eau tiède, alors qu’on ne pouvait pas faire l’inverse. Il y aurait donc chaleur et chaleur… Non ?
J’adore cette image pour expliquer l’entropie « Si vous descendez un escalier à califourchon sur la rampe, vous constaterez un léger échauffement de votre postérieur. En revanche, c’est pas en vous chauffant le cul que vous allez remonter ! » C’est exactement cela! Maintenant, cette crise d’énergie est tout de même bien une crise de source d’énergie ou une crise d’augmentation de l’entropie de la terre!
Pingback: Crise énergétique ? Mais non, cri...
J’adore le titre de cet article ! (ainsi bien sûr les explications qui suivent…)
Concernant le « paradoxe » du photovoltaïque, j’ai une question : Sachant que le capteur photovoltaÏque n’est pas un gaz, mais une quantité de matière solide concentrée plutôt que dispersée dans la boîte, ne serions-nous alors pas loin de l’équilibre thermodynamique ?
En gros, ce que je me dis, c’est qu’en radiant tel un corps noir, le capteur photovoltaïque se désintègre petit à petit, si bien que si on jette un oeil à la boîte des milliards d’année plus tard (ou peut-être faut-il attendre un googol d’années), il ne restera plus de capteur photovoltaïque dans la boîte… Juste du gaz.
Il y a déja des fabricants de ski qui luttent contre l’augmentation de l’entropie avec des fibre piezo électriques! 😉
http://www.industrie-techno.com/sport-un-ski-piezoelectrique-qui-s-adapte-a-la-neige.226
Très bon article, j’aime bien.
Attention cependant, pour être tout à fait rigoureux, il faudrait veiller à ne pas parler d’énergie thermique, mais d’énergie interne. Le transfert thermique Q est un mode de transfert de l’énergie, mais ce n’est pas une des formes de l’énergie. La forme d’énergie associée à la température, c’est l’énergie interne U (d’ailleurs, U est une fonction d’état. Q non). De même, on ne peut pas parler d’énergie électrique comme étant une forme de l’énergie, c’est un mode de transfert, via le travail électrique W.
Le panneau photovoltaique va recuperer une partie de la chaleur du boulet pour produire de l’electricite. Mais une autre partie va servir à rechauffer le panneau et la boite, celle-ci est perdue, sans compter celle qu’il vous a fallu pour mettre le boulet dans la boite….
Hey ! On a qu’à aller faire des glaçons dans l’espace et les ramener dans l’atmosphère !
(super article, super blog. Très heureux de m’être retrouvé ici par hasard)
A reblogué ceci sur Deux pirates en transitionet a ajouté:
Trois manières de donner 10 MJ a un boulet. Mais quel boulet?
Formulée ainsi, ton énigme me rappel étrangement le démon de Maxwell 🙂
Pingback: Crise énergétique ? Mais non, crise entropique !
Concernant votre énigme, rien ne me choque, à moins que j’ai mal compris. Le second principe n’empêche en rien de passer de l’énergie thermique à l’énergie potentielle (électrique dans ce cas), mais il empêche seulement (et malheureusement) de convertir la totalité de cette énergie thermique en énergie potentielle. C’est le principe même de tous les moteurs thermiques.
Très bon article de vulgarisation sinon.
Vous devriez regarder du côté des concepts d’exergie et d’anergie, c’est passionnant et ça reformule le premier et second principe. Si vous ne connaissez pas déjà, cela devrait vous intéresser.
tout a fait d accord avec pierre marty. chauffez de l air dans un ballon, votre ballon s envolera. une partie de la chaleur est convertie en energie mecanique. cela temoigne d une incomprehension concernant l entropie.
de plus, le deuxieme principe est present pour prendre en compte la notion d irreversibilite (qui n est pas prise en compte par le premier principe, qui n est qu un bilan), que je trouve d ailleurs tres bien expliquee par l exemple final…
L un des aspects de l irreversibilite est que toutes les energies ne se valent pas, car seule une conversion partielle d une energie desordonnee vers une energie ordonnee est possible. cet aspect de l entropie est bien explique.
Un autre aspect, qui est d ailleurs le plus simple et qui n est pas du tout aborde dans cet article, est le fait que la chaleur se transmet du chaud vers le froid, ce qui est irreversible.
Ainsi, quand vous melangez de l eau chaude et de l eau froide, bien que l energie totale du systeme ne varie pas, et que vous ne changez pas une energie ordonne en energie desordonnee, vous faites croitre l entropie.
Thank you, I enjoyed reading this. If you will forgive me commenting in English, my take on the ‘conserve energy’ message from Europe’s energy ministers is that it is meant to be understood in the context of non-renewables, principally fossil fuels, by avoiding waste in terms of energy conversion efficiency (e.g. improving the thermal efficiency of power stations and heat engines), and in terms of unnecessary use of fuel (e.g. heating and lighting of unoccupied buildings). Economising in the use of renewables such as wind at wave energy is devoid of meaning and presumably not intended. The 1st law consequence that ‘energy is always conserved’ is of course an in-joke among us cognoscenti. I doubt that the likes of Mme Royal would understand such arcane truisms, or even want to.
Peter at CarnotCycle
Crise entropique et anthropique. Intéressante homophonie!
Bonjour,
Je me permets de vous demander votre avis sur l’effet Dumas.
Jean-Jacques Dumas aurait obtenu, avec expérience à l’appui, un rendement de 116 pour cent, en thermodynamique…
Médecin de profession, je ne peux me faire une idée et ai besoin de vos lumières, même brièvement.
En vous remerciant beaucoup à l’avance…
Un lecteur assidu et admiratif !
Dr Jean Luc L
Celui qui dit qu’il peut y avoir une fusion nucléaire si la taille de son « truc » dépasse une certaine taille ?
petit article d’un (très) sceptique :
http://lehollandaisvolant.net/index.php?mode=links&id=20140416173307
Merci beaucoup, c’est très clair … Bonne soirée JL Lauliac
>
Aucun paradoxe à pouvoir récupérer un peu d’énergie « potentielle », « concentrée » dans le boulet. Tant que l’ensemble boulet+panneau n’est pas à l’équilibre thermique, il y a transfert de chaleur par rayonnement du plus chaud vers le plus froid. L’énergie de ce transfert peut être récupérée comme on récupère celle d’une chute d’eau. Mais quand l’équilibre thermique est atteint, le rayonnement s’arrête, et le panneau ne produira plus d’électricité.
Notons que la chaleur du boulet pourrait être récupérée aussi par effet thermoélectrique dans un dispositif approprié. (http://fr.wikipedia.org/wiki/Effet_thermo%C3%A9lectrique) (Pas par rayonnement, mais par conduction.)
Le prof n’aurait-il pas du dire : « En revanche, c’est pas en vous refroidissant le cul que vous allez remonter ! » ? plutôt que réchauffer.
Non, c’est ce que j’ai pensé pendant un moment, mais dans ce sens là c’est plus subtil. L’idée centrale du second principe, c’est que l’énergie ne se transforme pas spontanément d’une forme diluée à une forme concentrée, mais que l’inverse est possible.
Donc :
* je fournis de l’énergie potentielle (en grimpant), elle peut se transformer spontanément en énergie thermique (ça descend et chauffe)
* mais si je fournis de l’énergie thermique (en me chauffant le cul), elle ne peut pas s’échanger spontanément pour de l’énergie potentielle.
Pingback: Crise énergétique ? Mais non, crise entropique ! - Adrastia
Pingback: Parrain.fab | Pearltrees
Je suis sidéré par toutes ces réflexion « scientistes ». Vous énoncez côte à côte des principes physiques que vous ne replacez pas dans leur contexte et qui n’ont alors plus aucune signification scientifique. Nous devons envisager non seulement que le système mécanique dans lequel nous évoluons (l’environnement) n’est pas FERME, mais aussi que les transformations énergétiques réelles dont nous parlons ne sont pas RÉVERSIBLES Dans un système réel (non fermé), le passage d’une forme d’énergie en une autre forme as toujours un rendement inférieur à 1 entraînant cette fameuse perte d’énergie utile, donc une augmentation de l’entropie universelle (donc de l’Univers).
Pingback: Projet CX - P2P (03) Dematerialization Agri etc | Pearltrees
A reblogué ceci sur Swiss Coaching Partners.
Pingback: Crise énergétique ? Mais non, cri...
Un panneau photo voltaïque marche avec des photons et non avec un rayonnement thermique.
Question con, mais si on refroidis un systeme au lieu de le chauffer, alors l’agitation thermique diminue. A t-on diminuer l’entropie (ce qui semble impossible) ?
Si on considère un objet que l’on place dans un frigo, l’entropie de cet objet va bel est bien diminuer. Cependant, pour faire diminuer son entropie, le compresseur du frigo à dû fonctionner, consommer de l’électricité pour pomper la chaleur de l’intérieur du frigo vers l’extérieur. Au final, la diminution de l’entropie de l’objet n’est rien en comparaison de l’entropie qui est diffusée vers l’extérieur par le frigo et encore moins comparé à toute la chaîne qui à permis de produire et transmettre l’électricité jusqu’au compresseur. Dans la globalité la variation d’entropie sera toujours négative.
zut, la variation d’entropie sera toujours positive.
Ok, merci 🙂
La chaleur peut être convertie en énergie mécanique (moteur Stirling) ou électrique (hollow flashlight, Calopile, et tous les générateurs thermoélectriques, voire certaines centrales électriques solaires comme la « tour solaire » israélienne en cour de construction)
Je me suis toujours demandé pourquoi, pour exploiter l’énergie solaire à petite échelle, on n’employait que des panneaux solaires. J’aimerais fabriquer un capteur solaire composé de deux masses d’eau. Une masse d’eau chaude chauffée par thermosiphon solaire et une masse d’eau froide refroidie par thermosiphon céleste.
Ces 2 cuves, l’une chaude et l’autre froide seraient reliées par un troisième thermosiphon dont je recueillerais l’énergie à l’aide d’une turbine ou d’une « Calopile ».
L’avantage de ce système par rapport aux capteurs photovoltaïque serait double.
1) il posséderait une certaine inertie qui ferait qu’un nuage n’arrêterait pas la production d’électricité
2) Il n’exploiterait pas que le rayonnement solaire diurne mais aussi la radiation céleste nocturne, ce qui contribuerait à une grosse inertie énergétique du système qui pourrait probablement continuer à produire de l’électricité même après une interruption de 24, 48 ou 72 heures, du soleil
C’est un dispositif qui permettrait de vivre en autarcie énergétique qui, de mon point de vue, serait beaucoup plus intéressant que les panneaux photovoltaïques traditionnels qui sont trop tributaires de l’ensoleillement directe. Je lance cette idée comme une bouteille à la mer.
Merci à l’auteur pour cet article très bien rédigé.
Pingback: Crise énergétique ? Mais non, crise entropique ! |
par rapport à votre petite enigme, je me demande si la solution ne vient pas de la relation E=MC2. En rayonnant, le boulet perd une part (infime) de masse qui est convertie en energie electrique sur une une certaine longueur d’onde.
Enfin il est aussi possible que j’ai tout faux :))
Super question et très pédagogique.
Je pense que tu viens juste de demontrer par l’absurde que la temperature de rayonnement doit être strictement supérieure à la température de la cellule pour produire de l’électricité. Dans ton cas les températures sont identiques et il n’y a donc pas de variation nette des niveaux d’excitation dans la cellule.
Article sympas en terme de vulgarisation scientifique.
Pour ce qui est du boulet et du panneau photovoltaïque dans leur boîte, il faut juste de dire que dans photovoltaïque il y a photo et non thermo. Pas de photons (lumière), pas d’électricité. Or même chauffe à blanc la lumière reste blafarde et la chaleur ne favorise pas les rendements photovoltaïques.
Il est même possible que les composants du panneaux ne supporte pas la chaleur et brûlent avant même de produire le même électron.
Un thermocouple où un moteur Stirling serait plus efficace mais non sans source froide et donc à un moment donné des contacts en dehors de la boîte, une dispersion de chaleur et une augmentation de l’entropie.
Merci
Concernant le petit dilemme de la fin : je pense que le dilemme en est un parce qu’on en pose mal les termes.
Il y a selon moi deux erreurs :
1/ Considérer que le boulet chauffé est « plus entropique” que l’électricité (pourquoi ?) Parce que certaines formes d’énergies auraient une valeur moindre que d’autres, notamment la forme thermique ? Pourtant, nos centrales nucléaires y font appel …
2/ Se focaliser sur 2 éléments du système clos (boulet, panneau), en oubliant le 3ème élément du système… (suspens !)
_ _ _ _ _ _
Le 2eme principe n’implique pas que le « boulet chauffé » soit une énergie particulièrement inexploitable, un état particulièrement entropique… pas plus que la pile (enfin : je crois).
Se dire cela focalise sur ces deux éléments : le “réactif” (ou le donneur) et le “produit” (ou le receveur).
Or : on pourrait considérer ces formes d’énergie comme “équivalentes” – considérer qu’elles sont « utilisables, mais différemment », avec simplement un rendement + ou – important lors de leur exploitation (on est bien d’accord).
Dans l’exemple, reformuler cela ainsi aide à réaliser que :
le boulet ne va pas rayonner toute son énergie de façon exploitable pour le panneau.
Une quantité d’énergie va “sortir” de la réaction, en “sous-produit” de celle-ci,
et va aller réchauffer … l’AIR AMBIANT ! !
⇒ C’est ce mécanisme de “gaspillage” qui fait passer de l’énergie d’un système A à un autre système B + “par la fenêtre” C.
⇒ C’est cette “fuite en avant de l’énergie” ; “vers la fenêtre” ; et ce : dès qu’elle en a l’occasion, que traduit le second principe. Plutôt qu’une notion de “qualité de l’énergie”, assez ethnocentrée/subjective. Il est donc impropre de traduire le 2ème principe par “la qualité de l’énergie ne peut que se dégrader”. C’est plus sa “répartition” qui ne peut que “se dilapider”.
Autrement dit :
La PROPORTION de l’énergie “gaspillée” définit mieux le niveau + ou – entropique d’une réaction ;
plutôt que la forme de la source d’énergie (même si on est d’accord qu’il y a un lien : une source de chaleur aura un plus gros potentiel de dissipation de l’énergie qu’un système électrique dont celui-ci se limitera à l’effet-joule).
Le 2eme principe
ne donne pas tant d’information sur le devenir de l’énergie qui est effectivement transformée,
que sur le devenir de l’énergie « marginale », “gaspillée”, “dissipée” lors de la transformation.
Il en dit une chose assez simple : cette dissipation n’est jamais nulle. Ou en tout cas : jamais négative.
Et dans notre exemple, elle est même très importante :
c’est l’ensemble des Joules qui sont venues ÉLEVER LA TEMPÉRATURE de L’AIR de la boîte, et qui ne se retrouveront donc ni dans le boulet (tiède, froid …) ni dans le système électrique.
Fin du “mystère” (enfin je crois, non ?) …
Erratum : « ethnocentré » à remplacé par « anthropocentré ».
Imagine qu’on dispose d’un condensateur électrique parfait. On le charge et on le branche à notre boulet. Par effet Joules le boulet verra sa température augmenter. Or cette réaction se fait spontanément ce qui signifie que l’entropie à augmenté. On en conclue donc qu’il y a moins d’entropie dans le condensateur chargé que dans le boulet chauffé.
Pingback: Crise énergétique ou crise entropique ? | Science étonnante
Bonjour, je ne peux pas dormir!
Ok, un réacteur nucléaire produit de la chaleur, cette chaleur est utilisée pour transformer l’eau liquide en gaz. La vapeur va faire marcher une turbine, qui va créée de l’électricité.
N’est-ce pas un bon moyen d’utilisation thermique ?
Le second principe de la thermodynamique dit que l’entropie d’un système isolé ne peut qu’augmenter. Oui, mais ce n’est pas vrai de l’énergie thermique, qui elle, peut diminuer. Elle est égale à l’entropie multipliée par la température. En baissant la température sans trop augmenter l’entropie, on peut récupérer de l’énergie libre.
Le boulet chauffé à blanc émet de la lumière, la lumière est transformée en énergie électrique par la cellule photovoltaïque puis en énergie chimique stockée dans la batterie. La température du système T diminue. L’énergie thermique ST peut diminuer même si l’entropie S ne diminue pas et c’est cette diminution qui rend possible l’augmentation de l’énergie libre de la batterie.
Ashokan l’a déjà mentionné le 14 AVRIL 2014 mais apparemment son commentaire est passé inaperçu.
Bonjour David,
Tout d’abord merci pour cette excellente explication comme d’habitude ! Elle aborde un sujet complexe de manière très pédagogique ! Si je peux me permettre une toute petite critique, la nouvelle vidéo sur le sujet aurait pu être un peu plus longue, mais j’imagine la charge de travail que cela représente.
Ce sujet de l’entropie m’a néanmoins beaucoup intrigué et a amené quelques questions que je te soumet :
– La première est sous la forme d’une énigme, tel le boulet et le panneau photovoltaïque, celle du moteur Stirling. En effet, celui-ci transforme un différentiel de température en mouvement cinétique. Si on met un boulet très chaud dans un cube isolé avec un moteur Stirling, celui-ci sera bien capable de tourner, au moins quelques rotations, jusqu’à ce que tout l’air contenu dans le cube soit chaud. ça viole aussi le principe de la thermodynamique, non ?
Deuxième question, à laquelle je ne sais même pas si une réponse existe :
– Au début de l’univers, peu après le Big Bang, l’univers entier était contenu dans un « faible » volume et à une température extrêmement élevée. Or, depuis, l’univers s’est refroidi, puisque des points de l’univers sont à des températures nettement plus faibles. L’entropie aurait donc diminuée ? Comment cette chaleur originelle s’est-elle dissipée ?
Est-ce qu’on sait pourquoi ou est-ce que cela fait partie des mystères encore non résolus de l’univers ?
Merci à toi,
Simon