 Initialement, j’avais prévu de sortir ce billet la semaine dernière. Et puis je me suis dit que publier un billet sur l’eau en poudre le 1er avril, ça allait passer tout de suite pour une mauvaise blague.
Initialement, j’avais prévu de sortir ce billet la semaine dernière. Et puis je me suis dit que publier un billet sur l’eau en poudre le 1er avril, ça allait passer tout de suite pour une mauvaise blague.
Et pourtant c’est très sérieux ! Ce phénomène amusant est bien réel, et permet de fabriquer une poudre composée à 95% d’eau, comme celle représentée sur l’image ci-contre. Le principe de l’eau en poudre a été développé ces dernières années, et les applications potentielles existent dans de nombreux domaines. Alors arrêtez de rire, et lisez la suite !
La recette de l’eau en poudre
 Pour fabriquer de l’eau en poudre, c’est très simple : il vous faut de l’eau…et de la poudre ! Mais attention, pas n’importe quelle poudre : choisissez une poudre hydrophobe, c’est-à-dire faite d’une substance qui n’aime pas l’eau.
Pour fabriquer de l’eau en poudre, c’est très simple : il vous faut de l’eau…et de la poudre ! Mais attention, pas n’importe quelle poudre : choisissez une poudre hydrophobe, c’est-à-dire faite d’une substance qui n’aime pas l’eau.
Déposez une goutte dans la poudre et faites la rouler doucement : sa surface extérieure se recouvre de poudre, et vous obtenez ce qu’on appelle une goutte enrobée. Vous en avez une illustration ci-contre, tirée de l’article fondateur [1] publié en 2001 par David Quéré et Pascale Aussilous de l’EPSCI. La goutte enrobée est l’élément de base de l’eau en poudre.
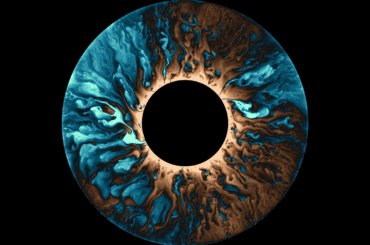
 En effet si maintenant vous utilisez beaucoup d’eau et beaucoup de poudre, et que vous touillez le mélange bien fort, vous pouvez obtenir un tas de gouttes enrobées. C’est ce qu’ont réalisé les physiciens B. Binks et R. Murakami en 2006. L’image d’en-tête de ce billet est tirée de leur article [2] : il s’agit d’eau en poudre, composée à 95% d’eau et à 5% de poudre hydrophobe. Malgré cela, le tas obtenu se comporte comme une poudre, et il est sec au toucher.
En effet si maintenant vous utilisez beaucoup d’eau et beaucoup de poudre, et que vous touillez le mélange bien fort, vous pouvez obtenir un tas de gouttes enrobées. C’est ce qu’ont réalisé les physiciens B. Binks et R. Murakami en 2006. L’image d’en-tête de ce billet est tirée de leur article [2] : il s’agit d’eau en poudre, composée à 95% d’eau et à 5% de poudre hydrophobe. Malgré cela, le tas obtenu se comporte comme une poudre, et il est sec au toucher.
L’image ci-contre [2] montre une photo de l’eau en poudre prise au microscope électronique : on y distingue la coque de particules qui enrobe chaque goutte d’eau et l’empêche de fusionner avec ses voisines, comme cela serait le cas avec des gouttes d’eau normales.
Si vous voulez faire vous-même l’expérience de la goutte enrobée, tout est dans le choix adéquat de la poudre ! Le papier d’origine utilisait notamment des spores de lycopodes, une poudre naturelle issue d’une plante vivace, et connue des illusionnistes pour ses utilisations pyrotechniques (et donc disponible dans toute bonne boutique de magie).
Si vous disposez d’un labo bien fourni, vous pouvez aussi essayer la poudre de PTFE (ce polymère appelé aussi « Téflon », et connu pour ses propriétés hydrophobes), ou encore de la silice hydrophobée, qui est assez analogue au célèbre « sable magique » qui ne se mouille jamais.
Des gouttes non-mouillantes
Les gouttes enrobées qui composent l’eau en poudre se comportent de manière très différente des gouttes normales. Quand on pose une goutte d’eau sur un support, elle prend la forme d’une calotte sphérique : on dit que la goutte mouille la surface. Plus le support est hydrophile, plus la calotte sera étalée; plus il est hydrophobe, plus la goutte aura la forme d’une sphère.

 En revanche une goutte enrobée conserve une forme presque parfaitement sphérique, quelle que soit la surface sur laquelle on la pose. Sa surface de contact avec le support peut alors être très faible, et la coquille de poudre qui l’entoure empêche tout contact du liquide avec le substrat. Cette différence est illustrée ci-dessus.
En revanche une goutte enrobée conserve une forme presque parfaitement sphérique, quelle que soit la surface sur laquelle on la pose. Sa surface de contact avec le support peut alors être très faible, et la coquille de poudre qui l’entoure empêche tout contact du liquide avec le substrat. Cette différence est illustrée ci-dessus.
On peut même poser une goutte enrobée sur un plan d’eau pour la faire flotter ! (comme sur l’image ci-contre tirée de [3]) Là aussi grâce à l’enrobage, le liquide de la goutte ne sera jamais en contact direct avec l’eau de la surface.
Vaincre les forces de surface
 Le principe de l’enrobage des gouttes n’est pas nouveau. S’il a été découvert et breveté en 1968, les pucerons l’utilisent déjà depuis quelques millions d’années ! En effet ces derniers secrètent par l’anus une substance sucrée, le miellat, très prisée notamment des fourmis.
Le principe de l’enrobage des gouttes n’est pas nouveau. S’il a été découvert et breveté en 1968, les pucerons l’utilisent déjà depuis quelques millions d’années ! En effet ces derniers secrètent par l’anus une substance sucrée, le miellat, très prisée notamment des fourmis.
Mais les pucerons sont sous la menace permanente de se trouver englués dans leur propre miellat ! Pour éviter cette catastrophe, certains pucerons ont en charge d’enrober les gouttes à l’aide d’une substance cireuse, et de les évacuer en les faisant rouler.
La raison qui rend les gouttes enrobées intéressantes technologiquement est la même que pour les pucerons : les gouttes enrobées sont beaucoup plus facile à déplacer que les gouttes normales. Pour comprendre cela, il faut réaliser qu’une petite goutte d’eau sur une surface est en général très difficile à bouger. J’en veux pour preuve que si vous soufflez sur une goutte déposée sur du verre, elle va rester solidement accrochée. Et même si vous retournez votre morceau de verre pour mettre la goutte la tête en bas, celle ci ne tombera pas !
La raison de ce phénomène, c’est que pour une petite goutte de liquide, les forces d’adhésion en surface sont énormes rapportées à sa taille. Elles sont donc très difficile à vaincre pour déplacer la goutte. Avec les gouttes enrobées, plus de problèmes ! Puisqu’elles ne sont plus en contact direct avec le substrat, elles sont faciles à mettre en mouvement avec une faible force. Certains auteurs ont même imaginé utiliser comme poudre enrobante une substance contenant de l’oxyde de fer, afin de pouvoir déplacer les gouttes par magnétisme !
 De plus l’enrobage de la goutte la protège de certains inconvénients des gouttes normales : l’enrobage protège en partie de l’évaporation, en se déplaçant la goutte ne perd pas de liquide, et elle n’est pas contaminée par la surface sur laquelle elle se déplace.
De plus l’enrobage de la goutte la protège de certains inconvénients des gouttes normales : l’enrobage protège en partie de l’évaporation, en se déplaçant la goutte ne perd pas de liquide, et elle n’est pas contaminée par la surface sur laquelle elle se déplace.
Plusieurs applications possibles existent en cosmétique ou dans l’industrie pharmaceutique, pour la délivrance contrôlée de petites quantités de médicaments, ou encore le transport de liquides dangereux. Enfin comme le montre l’illustration ci-contre, les gouttes enrobées peuvent aussi servir de microréacteurs pour des réactions chimiques, ou dans le domaine dit de la microfluidique.
Bref l’eau en poudre est loin d’être un poisson d’avril !
D’autres billets sur des sujets analogues : l’origine des ronds de café, et pourquoi les produits qui lavent sont aussi ceux qui moussent ?
Pour aller plus loin…un peu de thermodynamique !
Certains d’entre vous peuvent se demander pourquoi est-ce qu’une poudre hydrophobe irait se coller à la goutte d’eau, alors que justement elle est hydrophobe ! Pour comprendre cela, il faut considérer comment l’énergie du système eau/particule de poudre évolue si la goutte se colle à la surface. On sait qu’un système physique cherche toujours à minimiser son énergie.
Or à toute interface (eau/air, eau/solide ou air/solide) est associée une énergie proportionnelle à la surface S de l’interface, avec une constante \(\gamma\) qui dépend de la nature de l’interface.
 Quand une particule initialement dans l’air vient se coller à la surface de la goutte, une partie de l’interface eau/air disparaît, et une partie de l’interface particule/air est remplacée par une interface particule/eau.
Quand une particule initialement dans l’air vient se coller à la surface de la goutte, une partie de l’interface eau/air disparaît, et une partie de l’interface particule/air est remplacée par une interface particule/eau.
Pour ceux qui aiment les détails, la variation d’énergie libre lors de l’adsorption est
\(\Delta F = S_{SG}(\gamma_{SL}-\gamma_{SG}) – S_{LG}\gamma_{LG}\)
Si on injecte la définition de l’angle de contact
\(\cos\theta = (\gamma_{SG} – \gamma_{SL})/\gamma_{LG}\)
On obtient
\(\Delta F = – \gamma_{LG} (S_{SG}\cos\theta + S_{LG})\)
Maintenant pour montrer que ce terme est forcément négatif, il n’y a plus qu’à se convaincre que le terme entre parenthèses est forcément positif. Un dessin comme-celui ci-dessus devrait faire l’affaire !
Donc quelle que soit l’hydrophobicité de la particule (ou – c’est équivalent – l’angle de contact), l’opération conduit toujours à une diminution nette de l’énergie libre du système. Même la plus hydrophobe des particules trouvera toujours intéressant d’aller s’adsorber à la surface de la goutte d’eau.
(Ah oui sinon il parait même que l’eau en poudre permettrait de lutter contre le réchauffement climatique en sequestrant le CO2 , mais pour moi ça sent un peu la survente du concept…)
[1] Aussillous, P., & Quéré, D. (2001). Liquid marbles. Nature, 411(6840), 924-927.
[2] Binks, B. P., & Murakami, R. (2006). Phase inversion of particle-stabilized materials from foams to dry water. Nature materials, 5(11), 865-869.
[3] Gao, L., & McCarthy, T. J. (2007). Ionic liquid marbles. Langmuir, 23(21), 10445-10447.
[4] Xue, Y., Wang, H., Zhao, Y., Dai, L., Feng, L., Wang, X., & Lin, T. (2010). Magnetic liquid marbles: a “precise” miniature reactor. Advanced materials, 22(43), 4814-4818.



25 Comments
si j’ai bien compris, la forme que prend la goutte sur un support ne dépend pas (que?) de la gravité. est ce que ça veut dire que dans l’espace, une goutte « posée » sur une surface hydrophile aurait la même forme que ce qui est montré plus haut?
Oui en fait dans mon dessin, j’ai negligé la gravité, ce qui est ok pour les petites gouttes, mais moins pour les grosses. Donc oui mon dessin montre exactement ce qui se passerait dans l’espace.
Très intéressant
Comment se comporte cette poudre dans le vide ?
Bonne question ! Je n’en sais rien !
Pour une goutte normale, outre le fait qu’elle va s’évaporer, on peut réflechir en terme d’équilibre de pression à l’interface : la pression hydrostatique dans la goutte est plus élevée que la pression de l’air extérieur, avec une relation
P_Liq = P_Air + gamma/R
où gamma est la tension de surface et R le rayon de courbure. Donc si on dimiminue P_Air, on déséquilibre l’interface, et l’ensemble devrait se partitionner en gouttes plus petites pour retrouver sa stabilité. Bon ça c’était pour une goutte normale. Ce que je ne sais pas, c’est dans quelle mesure la coque formee par les particules modifie la relation qui relie la pression hydrostatique a la pression exterieure…
Merci pour cet article passionnant. Une petite question : comment peut-on récupérer
ensuite l’eau sans la poudre ?
ah oui, je n’avais même pas pensé à l’évaporation, mais il y a peut-être plus simple ?
Plus simple, non; mais plus compliqué, oui ! On peut imaginer modifier l’hydrophilie des particules de la poudre enrobante, en jouant sur leur chimie de surface. On peut soit par exemple changer le pH, ou encore utiliser des tensioactifs dont la conformation se modifie par exemple sous l’effet d’une certaine lumière.
Oui, vous avez bien fait d’attendre un peu ! Si je comprends bien, il faut entendre le « en » de « eau en poudre » comme dans « eau en bouteille » 🙂
Est-ce que c’est de là que vient l’expression « la goutte d’eau qui a mis le feu aux poudres » ? Boooon ok, j’arrête !
Merci pour vos articles (et pardonnez moi pour le niveau de mes blagues).
Pingback: L’eau en poudre | C@fé des Sciences | Scoop.it
Pingback: Grorico's corner
Pingback: Surfaces et interfaces | Pearltrees
Comment fait-on pour passer de la poudre d’eau à l’eau liquide, comme elle était avant?
Il faut trouver un moyen de détacher les particules de l’interface. Il existe des tensioactifs qui sont activables, par exemple par la lumière, car leur conformation change. On peut imaginer les utiliser pour changer le degré d’hydrophobie de la surface des particules. Mais je ne sais pas si c’est la meilleure manière de faire !
Pingback: L'eau en poudre | Newsletter HTC - Semaine 34 |...
Pingback: L'eau en poudre | Inventive, innovation sourcin...
Pingback: Réserves d’eau en plein désert : un petit verre de brouillard ? | Le Monde et Nous
Pingback: L’adaptation des espèces aux climats extrêmes | Kidi'science
Bonjour,
Ha je pensais que l’on pouvais transformer par exemple un litre d’eau en poudres. (Exemple : pour les militaires et le voyage dans l’espace (péremption etc…)
l’eau (ses composées) en lui même peut-il être transformé en poudre ?
c bizzard de l’eau en poudre
Pingback: Récupérer l'eau | Pearltrees
mais a quoi sert l’eau en poudre
Dans le cadre d’un TPE sur l’eau en poudre nous nous demandions si vous pourriez nous indiquer quelles sociétés ont commencé à l’exploiter car bien que le sujet soit desormais quelque peu daté il est assez difficile de trouver des informations à ce sujet.
Merci d’avance.
bonjour Rodrigue, nous sommes des élèves de 1e, nous sommes actuellement en train de travailler sur l’eau sèche dans le cadre d’un TPE. Nous avons vu que vous avez également traité de ce sujet, est ce qu’il serait possible de prendre contact avec vous pour échanger quelques informations.
Pingback: L'adaptation des espèces aux climats extrêmes | Kidi'science
Est-ce que il aura moyen de lui retransformer encore en liquide ???