Au début de l’été, et après 18 mois de débats, il semble que l’affaire de la bactérie à l’arsenic ait été définitivement tranchée. La revue Science a en effet publié deux articles réfutant l’affirmation initiale de l’équipe de la NASA. En cette période estivale où je poste des rediffusions sur ce blog, j’en profite pour vous reservir mon article écrit à l’époque, et qui ne parle pas tant de la bactérie à l’arsenic, que des éléments chimiques qui sont indispensables à la vie telle que nous la connaissons.
 Difficile de passer à côté, la NASA vient d’annoncer avec tambours et trompettes la mise au jour d’une « nouvelle forme de vie », soi-disant basée sur l’arsenic.
Difficile de passer à côté, la NASA vient d’annoncer avec tambours et trompettes la mise au jour d’une « nouvelle forme de vie », soi-disant basée sur l’arsenic.
Mais il semble que cette découverte suscite déjà la polémique chez les scientifiques du domaine, et n’étant pas très compétent sur le fond, je me garderai bien de commenter le caractère solide ou pas de cette annonce.
Pourtant c’est une bonne occasion de revoir quelques principes de biochimie et de se replonger dans la classification périodique des éléments de Mendeleev, alors n’hésitons pas !
Un peu de cuisine biochimique de base
 Si l’on regarde de quoi les organismes vivants sont constitués, on retrouve toujours les 4 mêmes éléments chimiques : l’hydrogène (H), l’oxygène (O), le carbone (C) et l’azote (N). Outre la molécule d’eau H20 (qui nous compose à 65% !), ces 4 éléments sont les briques de bases des glucides, des lipides et des acides aminés qui constituent les protéines.
Si l’on regarde de quoi les organismes vivants sont constitués, on retrouve toujours les 4 mêmes éléments chimiques : l’hydrogène (H), l’oxygène (O), le carbone (C) et l’azote (N). Outre la molécule d’eau H20 (qui nous compose à 65% !), ces 4 éléments sont les briques de bases des glucides, des lipides et des acides aminés qui constituent les protéines.
A ces 4 éléments, il convient d’en ajouter deux, présents en plus petites quantités mais tout aussi indispensables : le soufre (S), qui intervient dans la composition de 2 des 20 acides aminés principaux (la cystéine et la méthionine), et le phosphore (P) qui rentre en particulier dans la structure en double hélice de l’ADN.
Dans la représentation ci-contre de la molécule d’ADN, les atomes de phosphore sont en jaune.
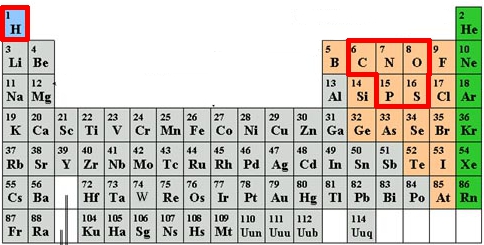
Bien sûr dans le corps humain, on trouve bien d’autres éléments chimiques comme le calcium des os ou le fer de l’hémoglobine. Mais ces traits ne sont pas forcément présent dans les autres organismes vivants. Si l’on s’en tient à l’ADN et aux acides aminés, principes biochimiques communs à tout le règne vivant, nous avons 6 éléments indispensables à la vie telle que nous la connaissons : C, H, O, N, P et S.
La classification des éléments
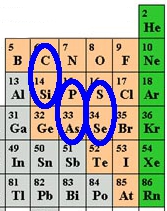
Ci-dessus on voit la position de ces 6 éléments dans le tableau de Mendeleev. Que peut-on en tirer sur l’existence possible de formes de vie alernatives ? Pour cela il faut tout d’abord se rappeler pourquoi le tableau de Mendeleev est un tableau.
Dans un tableau, il y a des lignes et des colonnes. Pour celui de Mendeleev, quand on lit une ligne du tableau, on parcourt les éléments classés par numéro atomique, c’est à dire le nombre de protons et d’électrons qu’ils comportent. Mais de manière surprenante, des numéros atomiques proches ne garantissent en rien des propriétés physiques et chimiques proches, au contraire.
Un exemple ? Le brome (35) est liquide halogène, le xenon (36) est un gaz inerte et le rubidium (37) est un métal alcalin. Pour trouver des atomes ayant des propriétés proches, il ne faut pas lire le tableau en ligne mais en colonne !
La classification périodique est…périodique
La vision en colonne est l’apport déterminant de la classification de Mendeleev : son coup de génie est en effet d’avoir remarqué qu’il existe une certaine périodicité dans les propriétés des éléments, et que des éléments éloignés par leur numéro atomique peuvent avoir des propriétés similaires. Mendeleev a alors groupé en colonnes ces éléments éloignés mais similaires : et c’est ainsi que l’on peut distinguer la colonne des métaux alcalins (la première), celle des alcalino-terreux (la seconde), ou encore celle des gaz rares (la dernière), etc.
Quand on lit le tableau de Mendeleev en colonnes, on trouve des éléments qui ont tendance à former des liaisons chimiques comparables. Par exemple tous les alcalino-terreux aiment se lier avec un atome d’oxygène : BeO, MgO, CaO, SrO, BaO, etc.
De la même manière, le carbone et le silicium partagent la capacité de former préférentiellement 4 liaisons avec leurs voisins. Ainsi les molécules organiques sont formées d’atomes de C, O et H, et si certains C du par szq Si, on obtient la grande famille des molécules dites silicones.
Les biochimies alternatives
 En se basant sur l’idée que des éléments de la même colonne peuvent former le même genre de liaisons chimiques, on peut imaginer des formes de vie alternatives dans lesquelles un ou plusieurs de nos 6 éléments CHONPS auraient été remplacés par des éléments « cousins », appartenant aux même colonnes.
En se basant sur l’idée que des éléments de la même colonne peuvent former le même genre de liaisons chimiques, on peut imaginer des formes de vie alternatives dans lesquelles un ou plusieurs de nos 6 éléments CHONPS auraient été remplacés par des éléments « cousins », appartenant aux même colonnes.
Une des substitutions les plus souvent envisagées est justement celle du carbone par le silicium. En théorie elle paraît séduisante, en pratique c’est plus difficile car d’une part le silicium a quand même moins tendance à se lier que le carbone, et d’autre part si on cherche à transposer le mécanisme de la respiration, le produit ne serait plus du CO2 mais du SiO2, c’est-à-dire du verre ! Respirer en rejetant du verre, ça paraît compliqué !
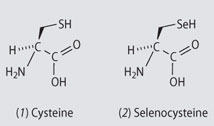 Une autre substitution possible, que l’on trouve même à l’état naturel, est celle du soufre par le selenium (Se) situé juste en dessous de lui dans le tableau. Ainsi l’acide aminé « cystéine » existe aussi dans une forme plus rare, la selenocystéine, dans laquelle un atome de Se remplace l’atome de soufre.
Une autre substitution possible, que l’on trouve même à l’état naturel, est celle du soufre par le selenium (Se) situé juste en dessous de lui dans le tableau. Ainsi l’acide aminé « cystéine » existe aussi dans une forme plus rare, la selenocystéine, dans laquelle un atome de Se remplace l’atome de soufre.
Enfin la substitution annoncée par l’équipe de la NASA serait celle du phosphore par l’arsenic. En fait la possibilité de cette substitution est bien connue car précisément à l’origine de la toxicité de l’arsenic. Puisque l’arsenic partage les mêmes propriétés que le phosphore, il a tendance à se substituer à lui dans les molécules du vivant et à saboter certains processus biochimiques dans l’organisme.
La découverte annoncée par la NASA correspondrait donc à une bactérie dans laquelle l’arsenic aurait véritablement remplacé le phosphore dans ses fonctions constitutives des molécules de base du vivant. L’avenir nous dira si la découverte se confirme. Et en attendant ces éclaircissements, profitons-en pour réécouter la recette du célèbre Pudding à l’arsenic !
[youtube=http://www.youtube.com/watch?v=shi9C368X0s]



4 Comments
Pingback: La bactérie à l’arsenic [rediffusion] | C@fé des Sciences | Scoop.it
Beau resume. Maintenant pour etre casse-pied il me semble que la structure du verre (avec une maille moyenne SiO2, meme si ca doit etre tres complique), n’a pas grand chose a voir avec une potentielle molecule isole de SiO2, si tant est qu’elle puisse exister.
En effet ! La principale différence est qu’à température ambiante le CO2 est gazeux, alors que la silice est solide. De surcroit le verre est un solide amorphe, et pas cristallin.
Sa structure est celle de « tétraèdres SiO4 », c’est à dire que chaque Si possède 4 voisins O, et que chaque O est lié à 2 Si. Le tout de manière non ordonnée, c’est à dire que les tétraèdres sont déformés.
Tient je me demande du coup si on sait faire du CO2 solide (carboglace) et aussi amorphe ? Et si sa structure est celle de tétraèdres CO4 ?
Ah ben oui, y a un Nature de 2006 sur le sujet !
http://www.nature.com/nature/journal/v441/n7095/full/nature04879.html