 Le verre est un étrange état de la matière. On entend parfois qu’il s’agit d’un liquide extrêmement visqueux, mais il est un peu plus que cela.
Le verre est un étrange état de la matière. On entend parfois qu’il s’agit d’un liquide extrêmement visqueux, mais il est un peu plus que cela.
Pour comprendre une partie de son secret, il ne faut pas seulement regarder ses propriétés physiques, mais aussi la manière dont il est fabriqué.
Les états de la matière
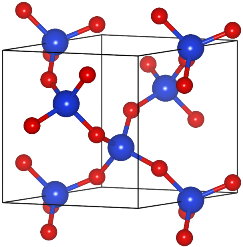 Comme on l’apprend à l’école, il existe essentiellement trois états de la matière : les solides, les liquides et les gaz. La caractéristique distinctive des solides est que ce sont des cristaux : quand on les regarde à l’échelle atomique, ils révèlent une structure ordonnée, où les atomes sont disposés en réseau cristallin.
Comme on l’apprend à l’école, il existe essentiellement trois états de la matière : les solides, les liquides et les gaz. La caractéristique distinctive des solides est que ce sont des cristaux : quand on les regarde à l’échelle atomique, ils révèlent une structure ordonnée, où les atomes sont disposés en réseau cristallin.
L’image ci-contre montre la structure cristalline du quartz (SiO2). Chaque atome de silicium (en bleu) y est lié avec 4 atomes d’oxygène (en rouge), selon un motif périodique.
La structure cristalline ordonnée des solides contraste avec la situation des liquides et des gaz, qui sont des états désordonnés. Au niveau microscopique, les molécules qui les composent sont distribuées de manière aléatoire, et pour cause elles n’arrêtent pas de bouger !
La structure du verre
Le verre de nos vitres et de nos bouteilles est un matériau solide, on peut donc penser qu’il possède lui aussi une structure cristalline. Mais si on le regarde à l’échelle microscopique, ça n’est pas le cas ! Les atomes qui le composent sont distribués de manière totalement désordonnée, comme dans un liquide. Et pourtant ces atomes sont bien figés et immobiles, comme dans un solide. On dit que le verre est un solide amorphe.
Vous le savez, on obtient du verre en faisant fondre du sable. Or le sable est essentiellement constitué de quartz, qui comme nous l’avons vu ci-dessus est un solide cristallin. N’est-ce pas contradictoire ?
Comment le verre peut-il être amorphe, alors qu’il est obtenu à partir de sable qui est cristallin ?
La réponse se trouve dans un phénomène dont j’ai parlé il y a peu : la surfusion. En chauffant et en refroidissant le quartz qui compose le sable, on peut l’amener à rester dans un état liquide sans que la transition vers le cristal ne se fasse. Le verre est un liquide en surfusion !
Une composition de verre classique (qui ne comprend pas que du sable) possède une température de cristallisation théorique autour de 1000°C. Mais on fait en sorte que jamais cette cristallisation ne démarre. Pour comprendre cet état de surfusion (un peu différent de celui de l’eau), il faut s’intéresser à la viscosité du verre en fusion.
La viscosité du verre
J’ai déjà parlé ici de la notion de viscosité, dont nous avons tous une idée plus ou moins intuitive. La viscosité des liquides dépend en général de la température. Pour le verre fondu comme pour beaucoup de liquides, plus sa température est élevée, plus il est fluide.
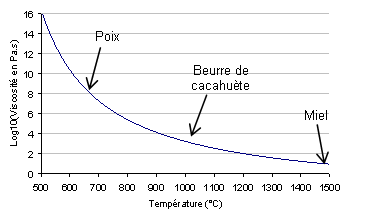 La figure ci-contre montre la viscosité d’un verre classique en fonction de sa température. Comme vous pouvez le voir, le changement de viscosité est tellement violent qu’il faut la représenter en échelle logarithmique.
La figure ci-contre montre la viscosité d’un verre classique en fonction de sa température. Comme vous pouvez le voir, le changement de viscosité est tellement violent qu’il faut la représenter en échelle logarithmique.
A 1500°C, le verre possède une viscosité proche de celle du miel (10 Pa.s, soit 10 000 fois la viscosité de l’eau), mais quand on le refroidit, elle augmente très rapidement. Tellement rapidement qu’à une température de 500°C, le verre est environ 10^19 fois plus visqueux que l’eau !
La fabrication du verre : la recherche de la surfusion
Voyons comment en pratique on atteint l’état de surfusion nécessaire à l’obtention du verre. On part de sable (et quelques autres ingrédients) que l’on chauffe à environ 1500°C. Supposons qu’on refroidisse le mélange à un taux sensiblement constant, et suivons ce qui se passe au cours du temps .
Le graphique ci-dessous représente l’évolution au cours du temps de la température (en bleu), de la viscosité (en rouge), et d’une troisième grandeur : la vitesse de cristallisation du mélange.
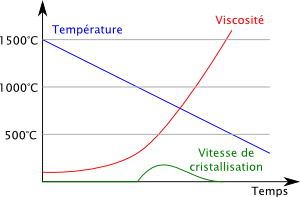 Entre 1500°C et 1000°C, le mélange se refroidit, sa viscosité augmente, et puisque nous sommes au dessus de la température de cristallisation (1000°C), la vitesse de cristallisation est nulle.
Entre 1500°C et 1000°C, le mélange se refroidit, sa viscosité augmente, et puisque nous sommes au dessus de la température de cristallisation (1000°C), la vitesse de cristallisation est nulle.
Quand la température atteint 1000°C, la cristallisation peut en principe commencer, mais démarre à une vitesse faible. Plus on refroidit notre verre sous les 1000°C, plus sa vitesse de cristallisation devrait augmenter. Mais assez rapidement l’augmentation de viscosité est telle qu’elle empêche la cristallisation, et la vitesse de cristallisation rechute vers zéro.
Vers 550°C, la viscosité est telle que les molécules sont totalement immobiles. Le verre est devenu un solide amorphe et on dit qu’on a passé la température de transition vitreuse.
Dans un véritable procédé de fabrication de verre, si on diminue suffisamment vite la température du verre, la cristallisation n’a même pas le temps de démarrer qu’elle est étouffée par la viscosité. Voilà pourquoi le verre est un liquide en surfusion.
Il n’y a pas qu’avec le verre classique qu’on peut obtenir un solide amorphe en refroidissant très vite un liquide en surfusion. On peut avec de tels procédés obtenir des verres métalliques, et même des verres d’eau (c’est à dire de l’eau solide amorphe !).
Du verre au bas des vitres ?
Pour finir, et pour les plus physiciens d’entre vous, attaquons nous à cette idée que l’on entend parfois quand on parle du verre comme étant un liquide très visqueux : la preuve en serait qu’au bas de certains vitrages anciens, on trouve que le verre est plus épais, comme s’il avait coulé.
Faisons un peu d’analyse dimensionnelle pour voir si ça a du sens. La viscosité s’exprime en Pa.s. C’est donc une pression multipliée par un temps. Calculons la pression que subit une vitre sous son propre poids, et déduisons en un temps caractéristique pour l’écoulement.
Supposons un verre de hauteur \(h\), de section \(S\) et de masse volumique \(\rho\). Le poids de la vitre est donc \(F=\rho g h S\). Puisqu’elle s’applique sur la surface \(S\), la pression de la vitre sur elle-même est \(P = F/S =\rho g h\). Pour une vitre de 1 mètre de haut avec une masse volumique d’environ 2500 kg/m3, ça fait une pression de l’ordre de 10^4 Pascals.
Par analyse dimensionnelle, on fabrique un temps à partir d’une pression \(P\) et d’une viscosité \(\eta\) en faisant \(\tau = \eta / P\). Faisons l’application numérique : même pour du verre à 500°C (viscosité 10^16), il faudrait 10^12 secondes pour qu’il ne coule sous l’effet de son propre poids. Ca fait quelques dizaines de milliers d’années ! Et je n’ai pris que la viscosité à 500°C…



35 Comments
Tu t’y connais en verre, toi! 😉
Si ce n’est pas le fait que le verre coule qui explique le renflement du verre, quelle est l’explication ?
J’ai aussi entendu cette histoire de coulure pour justifier que certaines vitres restées horizontales longtemps avaient tendance à se creuser. Pourquoi ?
Éléments de réponse dans le livre du grand tout :
http://en.wikipedia.org/wiki/List_of_common_misconceptions#Chemistry
Tiens, sympa cette page wikipédia, plein de futurs billets en perspective !
Et puis http://en.wikipedia.org/wiki/Glass#Behavior_of_antique_glass
Très intéressant cette explication de la surfusion du verre, merci! Par contre j’ai pas compris comment il faut lire le graphique de la vitesse de cristallisation: en abscisse, c’est le temps, et en ordonnée: la température?
Aïe, désolé de ne pas avoir été clair. En abscisse c’est bien le temps, en ordonnées je représente trois quantités, donc il faudrait que je mette trois axes verticaux distincts : un pour la température, un pour la viscosité, un pour la vitesse de cristallisation. Mais dans l’espoir de faire simple, je n’ai dessiné que l’axe des ordonnées pour la température.
Bon, et qu’est-ce qui se passe si on ne refroidit pas assez vite ? Il y a des inclusions cristallines dans le verre ? Est-ce que ça peut créer un effet esthétique ?
Quant aux verres de métaux ou d’eau, si tu me donnes par exemple un morceau de verre d’acier, est-ce que je vais voir la différence avec un bout d’acier cristallin (?) tout banal ?
En effet si on ne refroidit pas assez vite il peut y avoir cristallisation. Dans un procédé verrier, c’est une catastrophe ! On veille donc notamment à ce qu’il n’y ait pas d’endroit où du verre stagne à une température proche de celle de cristallisation.
Je ne sais pas si les inclusions peuvent créer un effet esthétique, mais l’idée des inclusions dans le verre est précisément ce qu’on appelle une vitrocéramique.
Pour en fabriquer, on fait d’abord du verre que l’on refroidit normalement. Puis dans un deuxième temps on le réchauffe jusqu’à la température de cristallisation, on laisse les cristaux nucléer et croître, puis on refroidit à nouveau (en fait on applique des traitements thermiques complexes pour contrôler nucléation et croissance, sachant qu’il peut y avoir plusieurs types de phases cristalline pour une composition de verre donnée…).
Quant aux verres métalliques, je n’en ai jamais vu. Mais on peut penser l’absence de structure cristalline change les propriétés électroniques de conduction, donc optiques (reflet par exemple ?)
Mais en quoi est-ce que c’est une catastrophe ?!
http://fr.wikipedia.org/wiki/Alliage_m%C3%A9tallique_amorphe !!!
H c une catastrophe car la partie cristallisée es opaque en opposition avec le bain de verre qui est translucide
Si je peux me permettre, la synthese de vitro-ceramiques ne necessitent pas de se placer a la temperature de crystallisation Tx (on evite meme afin de maitriser la nucleation). En effet, meme si une DSC peut donner l’impression qu’un verre ne crystallise pas en dessous de Tx, c’est pourtant totalement faux dans les faits. Petit exemple concret ds mon labo (specialise en verre pour la photonique): si, par exemple, je prend un de mes verres tellurites, dont la temperature de transition vitreuse Tg est ~260 degrees par exemple, ayant un critere de stabilite Tx-Tg au dela de 200 degree ( Tx a plus 460 degrees) et que je le met au four pendant 8 heures, a une temperature au dessus de temperature de transition vitreuse (mais bien en dessous de la temperature de crystallisation), le verre crystallisera eventuellement. Et malgre qu’un verre ait un critere de stabilite DeltaT, plus faible que le verre cite en exemple, cela n’indique pas forcement que le verre crystallisera aussi facilement.
Quand a ta section « La fabrication du verre : la recherche de la surfusion ». Vous auriez du preciser que vous parliez de silicates (de type alkaline silicates au vue des temperatures que vous citees). Il est important de noter que les verres de silica ne representent qu’une infime partie de notre science. Il existe les chalcogenures, les verres d’oxydes lourds, les phosphates, les fluorures mais aussi les verres metaliques.
Enfin quand tu dis : « Les atomes qui le composent sont distribués de manière totalement désordonnée », ce n’est malheureusement pas si simple. Disons a « longue » distance, c’est vrai, pourtant a « courte » voir moyenne distance, on peut voir se former des chaines, des anneaux et toute sorte de motifs. Evidemment, les motifs ne se repetent pas de maniere periodique mais on est loin du desordre d’un liquide. Il serait bien trop simple de penser qu’un verre a la structure du liquide surfondu. Ce n’est qu’en partie vrai!
Desole pour le manque d’accents et les fautes de francais, cela fait bien longtemps que je ne vis plus en France, et que je n’utilise quasi plus ma langue native.
http://fr.wikipedia.org/wiki/Alliage_m%C3%A9tallique_amorphe
Tiens j’en ai justement vu de mes yeux cette semaine :
http://www.fibraflex.com/documentations/DOCINT_FR2.pdf
Des fibres d’alliage Fer/Chrome amorphe. Plein de bonnes propriétés mécaniques !
quant a moi je cherche le moyen le plus simple et efficace pour fondre du sable afin d obtenir du verre
lien mort?
Pingback: L’expérience de la goutte de poix « Science étonnante
bonjour , j’ai un exposé pour demain que l’on vien de m’annoncer , seulement je n’est pas le temps et j’ai quelques diffucultés , pouvez vous m’aider, ( le sujet est : le verre=sable+gaz ( chauffé ))
Merci d’avance. Sinon mes felicitations pour le sites « Science étonnante ».
Si j’ai fait quelques fautes je m’en exuse, je suis jeune , et pas trés doué en Orthographe.
Si je disais demain c’etais parce que j’etais absente ! Non pas mauvaise éléve.
Pingback: Voyage au centre de la Terre | Science étonnante
Vous expliquez très bien le processus de fabrication du verre ! Heureusement, le verre ne mettrait que quelques dizaines de milliers d’années avant de couler sous l’effet de son propre poids ! Vous imaginez, des vitres qui coulent à cause de la chaleur ? Nous serions bien embêtés !
Comme les autres, les vitres et portes de chez As du carreau ne coulent pas 😉
Surement qq centaines de millions d’annees voir bcp plus si on est a temperature ambiante pour un verre de silica.
Pingback: KEZAKO: De quoi est composée la matière? Pourquoi est ce solide, liquide ou gazeux? - Lokoyote
Bonsoir a vous.
Question on ma dis qu’il y avais un colonne de verre créé exprès pour dé-montrer que le verre coule toujours mais très lentement mais bon elle a 100 ans un truc du genre.
Pas très précis je sais, à quant on ne peut même plus compter sur nos souvenir. Crétin de cerveau, comment sa c’est pas le lieu?!!
Là question c’est et-ce-que mes souvenirs son bon ou la personne ma raconter de bobards?!
Tes souvenirs sont bons en partie, Il ne s’agit pas d’un verre, mais d’un liquide avec un viscosite tres importante (une sorte de goudron).
https://www.youtube.com/watch?v=FAFRzAGnFs4
Pingback: Ab2lcpd | Pearltrees
Pingback: Tpeverre | Pearltrees
Si je peux me permettre, la synthese de vitro-ceramiques ne necessitent pas de se placer a la temperature de crystallisation Tx (on evite meme afin de maitriser la nucleation). En effet, meme si une DSC peut donner l’impression qu’un verre ne crystallise pas en dessous de Tx, c’est pourtant totalement faux dans les faits. Petit exemple concret ds mon labo (specialise en verre pour la photonique): si, par exemple, je prend un de mes verres tellurites, dont la temperature de transition vitreuse Tg est ~260 degrees par exemple, ayant un critere de stabilite Tx-Tg au dela de 200 degree ( Tx a plus 460 degrees) et que je le met au four pendant 8 heures, a une temperature au dessus de temperature de transition vitreuse (mais bien en dessous de la temperature de crystallisation), le verre crystallisera eventuellement. Et malgre qu’un verre ait un critere de stabilite DeltaT, plus faible que le verre cite en exemple, cela n’indique pas forcement que le verre crystallisera aussi facilement.
Quand a ta section « La fabrication du verre : la recherche de la surfusion ». Vous auriez du preciser que vous parliez de silicates (de type alkaline silicates au vue des temperatures que vous citees). Il est important de noter que les verres de silica ne representent qu’une infime partie de notre science. Il existe les chalcogenures, les verres d’oxydes lourds, les phosphates, les fluorures mais aussi les verres metaliques.
Enfin quand tu dis : « Les atomes qui le composent sont distribués de manière totalement désordonnée », ce n’est malheureusement pas si simple. Disons a « longue » distance, c’est vrai, pourtant a « courte » voir moyenne distance, on peut voir se former des chaines, des anneaux et toute sorte de motifs. Evidemment, les motifs ne se repetent pas de maniere periodique mais on est loin du desordre d’un liquide. Il serait bien trop simple de penser qu’un verre a la structure du liquide surfondu. Ce n’est qu’en partie vrai!
Desole pour le manque d’accents et les fautes de francais, cela fait bien longtemps que je ne vis plus en France, et que je n’utilise quasi plus ma langue native.
Petite precision quant a la crystallisation, certains verres meme ne presentent pas de pic de crystallisation en faisant une DSC (ou dilato). Certain de nos verres avec des Tg a 250-300 degrees ne presentent AUCUN pic de crystallisation dans l’interval de mesure (disons jusque 900 degrees). Cela veut-il dire que le verre ne crystallisera pas a 500? NON!
J’encourage vivement les gens interesses par la science des verres de lire ces 2 livres :
A. K. Varshneya, Fundamentals of inorganic glasses, Academic Press
J. E. Shelby, Introduction to Glass Science and Technology, RCS
J’ai lu quelque part (je ne sais plus où), que si les verres anciens semblaient avoir « coulé » comme du camembert, c’est parce qu’avant, on ne savait pas faire de verre d’épaisseur parfaitement régulière; par souci d’équilibrage, on mettait la partie la plus renflée en bas…
Hello,
Le verre n’est pas un liquide en surfusion, pas du tout. Tu dois modifier cet aspect de ton article. C’est un solide un vrai.
Merci pour ta chaîne et ton blog.
à plus!
Hello guiguifyz,
Relis bien l’article!
au plaisir.
Pingback: Quel Type De Vitrage Choisir Pour Mieux Isoler Votre Maison ?