 Il y a quelques jours, Daniel Nocera et son équipe du MIT ont annoncé avoir mis au point la première « feuille artificielle » [1]. Il s’agirait d’un dispositif qui, une fois plongé dans l’eau, permet de produire de l’hydrogène à partir de la lumière du soleil. L’hydrogène ainsi fabriqué serait alors facile à stocker ou à transporter.
Il y a quelques jours, Daniel Nocera et son équipe du MIT ont annoncé avoir mis au point la première « feuille artificielle » [1]. Il s’agirait d’un dispositif qui, une fois plongé dans l’eau, permet de produire de l’hydrogène à partir de la lumière du soleil. L’hydrogène ainsi fabriqué serait alors facile à stocker ou à transporter.
Cette annonce ayant fait un peu de bruit dans la blogosphère (là et là, par exemple), essayons de faire le point sur les principes physiques sur lesquels se base cette technologie.
Stocker l’énergie du soleil
Le soleil est aujourd’hui la source d’énergie renouvelable la plus abondante. Mais contrairement aux centrales classiques, l’énergie n’est pas disponible en continu au cours de la journée : il faut trouver un moyen efficace et peu cher de stocker cette énergie. Beaucoup de travaux sont donc menés pour imaginer des batteries plus performantes, moins chères et plus durables.
Pour mesurer la capacité d’un système de stockage d’énergie, on regarde ce qu’on appelle l’énergie spécifique : la quantité d’énergie (en Joules) que l’on peut stocker par kilogramme. Pour une batterie Li-ion, on est par exemple autour de 0.5 MJ/kg. La meilleure batterie du monde avoisinerait les 2.5 MJ/kg.
Mais ces performances de stockage des batteries sont à comparer à celles des combustibles : 50 MJ/kg pour du gaz naturel et près de 150 MJ/kg pour de l’hydrogène ! On voit que les combustibles sont une bien meilleure forme de stockage de l’énergie que les batteries ! (source)
Alors, plutôt que de faire des batteries, ne pourrait-on pas utiliser un combustible comme l’hydrogène pour stocker l’énergie solaire ? Eh bien si ! Grâce à un phénomène bien connu : l’électrolyse de l’eau.
L’électrolyse de l’eau
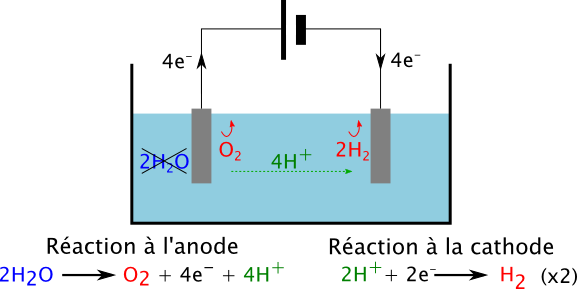
Comme vous le savez, l’eau est constituée d’hydrogène et d’oxygène, et l’électrolyse de l’eau permet à l’aide d’un courant électrique de séparer ces deux éléments. L’expérience de principe est représentée sur le dessin ci-dessous. Le phénomène global peut se décomposer en deux réactions chimiques, qui se produisent aux deux différentes électrodes.
La première réaction, qui a lieu à l’anode, dégrade l’eau en produisant un molécule de dioxygène, ainsi que 4 ions H+ et 4 électrons. La seconde réaction (à la cathode) combine les ions H+ et les électrons pour former du dihydrogène.
Pour aller de l’anode à la cathode, les ions H+ migrent dans le liquide, tandis que la tension électrique que l’on fournit achemine les électrons par le circuit électrique. A partir de mesures d’électrochimie, on sait même que la tension minimale nécessaire pour que les réactions puissent avoir lieu est de 1.23 Volts.
Faciliter l’électrolyse
 Bon ben voilà, on connecte notre panneau solaire à un dispositif d’électrolyse de l’eau, et on produit de l’hydrogène que l’on stocke, …et le tour est joué !? Oui…mais non.
Bon ben voilà, on connecte notre panneau solaire à un dispositif d’électrolyse de l’eau, et on produit de l’hydrogène que l’on stocke, …et le tour est joué !? Oui…mais non.
Malheureusement ça n’est pas si simple : les réactions en jeu dans l’électrolyse de l’eau ne sont vraiment pas très rapides. Pour obtenir un dispositif efficace, il nous faut catalyser ces réactions.
C’est particulièrement vrai de la réaction à l’anode, dite réaction d’oxydation de l’eau. Comme on le voit dans son équation, elle implique 4 électrons et sans rentrer dans les détails, plus il y a d’électrons impliqués, plus la réaction est compliquée à réaliser.
En pratique quand on fait l’électrolyse de l’eau, par exemple dans un TP de chimie ou dans un procédé industriel, on a recourt à plusieurs modifications : on travaille en milieu très acide (pH 1 par exemple), on utilise des électrodes en matériau catalyseur, comme du platine, et on délivre une tension sensiblement plus élevé que celle de 1.23 V qui serait en théorie suffisante (comme 6 ou 9 volts pour un TP).
Vous voyez que ça complique un peu notre idée de faire l’électrolyse directement à partir d’énergie photovoltaïque : le platine c’est cher, le pH acide c’est compliqué, et une cellule photovoltaïque délivre naturellement une tension de l’ordre de 1 à 1.5 volts.
La photosynthèse naturelle
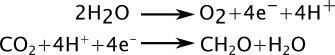
Une bonne source d’inspiration pour essayer de contourner ces problèmes, c’est de regarder ce que fait la Nature. En effet, la photosynthèse naturelle réalise exactement ce qu’on souhaite faire, c’est-à-dire stocker l’énergie solaire sous forme d’un combustible. Et ça n’est peut être pas évident de prime abord, mais la photosynthèse, c’est bien une électrolyse de l’eau !
Les deux réactions principales impliquées dans la photosynthèse peuvent en gros se schématiser de la manière suivante :
La décomposition de l’eau est une brique essentielle de la photosynthèse : d’ailleurs l’oxygène qui se dégage sous forme gazeuse n’est pas l’oxygène du CO2, mais celui de l’eau ! Comme dans l’électrolyse classique, on a deux réactions à réaliser, et comme dans l’électrolyse classique, la première de ces réactions est particulièrement difficile à initier. Elle a besoin d’être catalysée !
 Comme la nature est bien faite, elle possède un très bon catalyseur naturel de cette réaction. On l’appelle le système d’oxydation de l’eau (Oxygen Evolving complex), et sa structure a été seulement en partie élucidée. C’est un gros assemblage (voir ci-contre [2]), fait autour de 4 atomes de manganèse et d’un atome de calcium, et qui sait spécifiquement gérer le transfert des 4 électrons en faisant varier son état d’oxydation.
Comme la nature est bien faite, elle possède un très bon catalyseur naturel de cette réaction. On l’appelle le système d’oxydation de l’eau (Oxygen Evolving complex), et sa structure a été seulement en partie élucidée. C’est un gros assemblage (voir ci-contre [2]), fait autour de 4 atomes de manganèse et d’un atome de calcium, et qui sait spécifiquement gérer le transfert des 4 électrons en faisant varier son état d’oxydation.
Pour essayer d’améliorer l’électrolyse de l’eau alimentée par énergie photovoltaïque, il nous faut donc imiter la nature en trouvant un très bon catalyseur de la réaction d’oxydation de l’eau.
Les catalyseurs de Nocera
L’idée de coupler un dispositif photovoltaïque avec un catalyseur de l’électrolyse de l’eau n’est pas nouvelle. Le premier dispositif de ce genre a été rapporté par Turner en 1998 [3]. Toutefois le dispositif d’ensemble était assez compliqué et fait à partir de matériaux chers et peu stables.
La grande avancée publiée par Daniel Nocera il y a quelques années [4] a été la découverte d’un nouveau catalyseur de l’oxydation de l’eau, fait à partir de cobalt (ou de nickel [5]), et fonctionnant à pH 7, à température ambiante et sous pression atmosphérique : c’est-à-dire dans des conditions bien plus favorables que ce dont on disposait jusqu’ici pour faire l’électrolyse de l’eau !
Une fois un bon catalyseur de l’oxydation de l’eau découvert, on peut se dire qu’on a résolu un des problèmes les plus difficiles pour mettre en œuvre l’idée de photosynthèse artificielle. Mais il faut encore intégrer l’ensemble. Bien que la publication associée n’ait pas encore été dévoilée, on peut penser que c’est cette intégration qu’a réalisé récemment l’équipe de Nocera.
Le point sur la technologie
Tout d’abord, le catalyseur ne concerne qu’une des deux réactions, celle qui produit le dioxygène. Il se trouve que la réaction de l’hydrogène est plus facile à catalyser car elle met en œuvre le transfert de seulement deux électrons, mais on a quand même besoin d’un autre catalyseur, différent du premier.
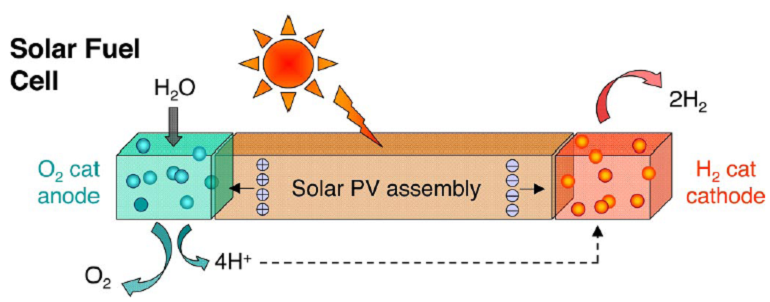
Ensuite, contrairement à ce qu’on peut penser, la découverte d’un super catalyseur ne nous dispense pas d’avoir un matériau photovoltaïque, par exemple du silicium. La feuille artificielle idéale se compose ainsi d’un matériau qui absorbe les photons pour les transformer en excitation électronique, et des deux catalyseurs qui récupèrent cette excitation pour produire oxygène et hydrogène à partir de l’eau. En ce sens on ne peut pas considérer cette technologie comme radicalement différente du photovoltaïque classique.
Le défi, c’est que si on arrive à bien intégrer tout (par exemple en déposant les catalyseurs directement sur le composé photovoltaïque), on peut éliminer toute la tuyauterie associée à la technologie photovoltaïque traditionnelle (les fils bien sûr, mais aussi les différentes couches, le fait de mettre les cellules en série, les onduleurs, etc.) Voici le schéma de principe présenté il y a quelques années par Dan Nocera [6]
Alors bien sûr une fois que tout ça marche et qu’on a l’hydrogène, on a fait que 50% du chemin. Il faut ensuite pouvoir utiliser cet hydrogène. On peut le brûler comme un combustible normal, mais on peut aussi s’en servir pour générer de l’électricité à l’aide d’une pile à combustible, qui pour l’essentiel…fait l’opération inverse de l’électrolyse de l’eau. La boucle est alors bouclée, mais technologiquement, c’est une autre histoire !
[1] L’annonce de Nocera au congrès de l’ACS
[2] Barber et al., Architecture of the Photosynthetic Oxygen-Evolving Center, Science 303 (2004)
[3] O. Khaselev et J. Turner, A Monolithic Photovoltaic-Photoelectrochemical Device for Hydrogen Production via Water Splitting, Science 280 (1998)
[4] M. Kanan et D. Nocera, In Situ Formation of an Oxygen-Evolving Catalyst in Neutral Water Containing Phosphate and Co 2+, Science 321 (2008)
[5] M. Dinca et al., Nickel-borate oxygen-evolving catalyst that functions under benign conditions, PNAS 107 (2010)
[6] D. Nocera, Powering the planet: Chemical challenges in solar energy utilization, PNAS 103 (2006)



10 Comments
Bonjour, j’étudie la photosynthèse, et je sais pas si vous pouvais me répondre à une de mes questions à ce sujet, mais je vais tout de même tenter.
Je ne comprends pas trop comment cela se passe à l’étape de l’absorption des photons par la chlorophylle.
Combien de photons correspondant aux longueurs d’ondes absorbées par la molécule de chlorophylle sont-il nécessaires pour exciter la chlorophylle et ainsi lui faire éjecter un électrons ?
Ou alors peut-être est-ce une question de longueur d’onde, à partir de combien de nm, l’éjection d’un électron est possible ?
Merci par avance!
Heu, de souvenir de terminale, je crois que la chlorophylle n’éjecte pas d’électrons mais tout se passe au niveau de transformation d’ADP en ATP, non?
d’ATP en ADP
j’ ai beaucoup apprecier le site et j’aimerais connaitre beaucoup sur la production de l’hydrogène, sa conservation et sa combustion.
Pingback: Technologies | Pearltrees
quand tu dis la boucle est bouclée à la fin… Cela signifie : énergie illimitée??
Non, ça veut dire que l’eau est retournée à son état initial. On a au total :
2 H2O + soleil => 2 H2 + O2 => 2H2O + électricité
Donc pas d’énergie illimitée, juste de l’énergie solaire convertie en électricité.
Pingback: La chimie de l’été indien | Science étonnante
Pingback: D’où vient l’oxygène de l’air que nous respirons ? | Science étonnante
Pingback: Vegetalia | Pearltrees